Рефераты по авиации и космонавтике
Рефераты по административному праву
Рефераты по безопасности жизнедеятельности
Рефераты по арбитражному процессу
Рефераты по архитектуре
Рефераты по астрономии
Рефераты по банковскому делу
Рефераты по сексологии
Рефераты по информатике программированию
Рефераты по биологии
Рефераты по экономике
Рефераты по москвоведению
Рефераты по экологии
Краткое содержание произведений
Рефераты по физкультуре и спорту
Топики по английскому языку
Рефераты по математике
Рефераты по музыке
Остальные рефераты
Рефераты по биржевому делу
Рефераты по ботанике и сельскому хозяйству
Рефераты по бухгалтерскому учету и аудиту
Рефераты по валютным отношениям
Рефераты по ветеринарии
Рефераты для военной кафедры
Рефераты по географии
Рефераты по геодезии
Рефераты по геологии
Рефераты по геополитике
Рефераты по государству и праву
Рефераты по гражданскому праву и процессу
Рефераты по кредитованию
Рефераты по естествознанию
Рефераты по истории техники
Рефераты по журналистике
Рефераты по зоологии
Рефераты по инвестициям
Рефераты по информатике
Исторические личности
Рефераты по кибернетике
Рефераты по коммуникации и связи
Рефераты по косметологии
Рефераты по криминалистике
Рефераты по криминологии
Рефераты по науке и технике
Рефераты по кулинарии
Рефераты по культурологии
Рефераты по авиации и космонавтике
Рефераты по административному праву
Рефераты по безопасности жизнедеятельности
Рефераты по арбитражному процессу
Рефераты по архитектуре
Рефераты по астрономии
Рефераты по банковскому делу
Рефераты по сексологии
Рефераты по информатике программированию
Рефераты по биологии
Рефераты по экономике
Рефераты по москвоведению
Рефераты по экологии
Краткое содержание произведений
Рефераты по физкультуре и спорту
Топики по английскому языку
Рефераты по математике
Рефераты по музыке
Остальные рефераты
Рефераты по биржевому делу
Рефераты по ботанике и сельскому хозяйству
Рефераты по бухгалтерскому учету и аудиту
Рефераты по валютным отношениям
Рефераты по ветеринарии
Рефераты для военной кафедры
Рефераты по географии
Рефераты по геодезии
Рефераты по геологии
Рефераты по геополитике
Рефераты по государству и праву
Рефераты по гражданскому праву и процессу
Рефераты по кредитованию
Рефераты по естествознанию
Рефераты по истории техники
Рефераты по журналистике
Рефераты по зоологии
Рефераты по инвестициям
Рефераты по информатике
Исторические личности
Рефераты по кибернетике
Рефераты по коммуникации и связи
Рефераты по косметологии
Рефераты по криминалистике
Рефераты по криминологии
Рефераты по науке и технике
Рефераты по кулинарии
Рефераты по культурологии
Курсовая работа: Сорбируемость меди на бурых углях, сапропелях и выделенных из них гуминовых кислотах
Курсовая работа: Сорбируемость меди на бурых углях, сапропелях и выделенных из них гуминовых кислотах
Министерство образования и науки Российской Федерации
Научно-образовательный центр
«ЭКОБИОТЕХНОЛОГИЯ»
Тульский государственный университет
КУРСОВАЯ РАБОТА ПО аналитической химии
Сорбируемость меди на бурых углях, сапропелях и выделенных из них гуминовых кислотах
Студент группы 430441 _____________ Агеева Е.Д
(подпись, дата)
Руководитель работы
_____________ к.х.н., с.н.с. Рогова Т.В
(подпись, дата)
Научный консультант ______________ к.б.н. Пунтус И.Ф
(подпись, дата)
Заведующий кафедрой _____________ Алфёров В.А.
(подпись, дата)
Тула, 2006г.
1. Введение
Проблема очистки воды для хозяйственно - питьевых нужд от токсикантов, в частности, от соединений тяжелых металлов, является весьма актуальной природоохранной проблемой в Тульском регионе, в котором сосредоточено множество крупных промышленных предприятий.
Из литературных источников известно, что в качестве сорбентов могут служить практически все мелкодисперсные твердые вещества, обладающие развитой поверхностью – бурые угли, сапропели, горелая порода шахтных выработок и другие. Изучению таких природных сорбентов, как сапропели, бурый уголь и гуминовые кислоты уделяется большое внимание. Множество научных работ посвящены изучению способов выделения, структуры и свойств гуминовых кислот, а также изучение их биологической активности. Были выявлены и сформулированы функции данных веществ, одна из которых, протекторная, играет важную экологическую роль, заключающуюся в способности гумусовых кислот связывать в малоподвижные или труднодиссоциирующие соединения токсичных элементов и не давать проникать токсикантам в торф, растения и т.п.
Целью работы является изучение сорбируемости меди на буром угле, сапропелях и выделенных из них гуминовых кислотах и минеральном сорбенте на основе горелой породы.
2. Литературный обзор
2.1 Сорбция меди на различных сорбентах
2.1.1 Сравнение сорбируемости меди на синтетических катионитах и анионитах
Содержание меди в промышленных стоках даже после проведения реагентной очистки превышает предельно допустимую концентрацию на 2-5 порядков. В связи с этим остро стоит проблема доочистки этих стоков до санитарных норм, традиционно решаемая с использованием ионитов.
В реальных растворах, полученных на установке реагентной очистки Ефремовского завода СК после проведения реагентной очистки натриевой щелочью присутствуют ионы меди (10 - 2000 мг/дм3), натрия (7 - 24 г/дм3), ацетат-ионы (0,5-3,5 моль/дм3) и аммиак (1-10 г/дм3). Для оптимизации процесса доочистки стоков до санитарных норм была исследована сорбируемость меди в динамическом и статическом режимах на синтетических сульфокатионитах КУ-1, КУ-2-8, КУ-2-20 (в Н- и Na-форме) и анионитах АВ-16Г, АВ-17-8, ЭДЭ-10П (в ОН- и Сl-форме).
Сравнение сорбируемости меди на катионитах в динамических условиях показало, что максимальные ее значения 2-4 мэкв/г (при концентрации меди в исходном растворе 2 г/дм3), сохраняющиеся при регенерации, имеют сильнокислотные катиониты КУ-2-8 и КУ-1 в Н-форме. Они проявляют высокую селективность к ионам меди даже в присутствии значительных концентраций катионов - натрия, вступающих в конкурирующее равновесие ионного обмена наряду с катионами меди (при мольных отношениях Na/Cu не превышающих 25). Показано, что при увеличении степени сшивки при переходе от КУ-2-8 к КУ-2-20, а также переходе от Н-формы к Na-форме катионитов сорбируемость меди значительно уменьшается.
Сорбируемость меди в динамических условиях на анионитах увеличивается по ряду : АВ-17-8< ЭДЭ-10П <АВ-16Г и для АВ –16Г достигает величин 3 и 4 мэкв/г (для солевой и ОН- форм соответственно), сопоставимых с сорбируемостью меди на катионитах КУ-2-8 и КУ-1. Исследование регенерации отработанных анионитов при обработке их раствором щелочи показали, что медь десорбируется лишь в незначительной степени, что объясняется образования прочных комплексов меди с функциональными группами, в частности этилендиаминными, входящими в состав анионитов. Величины сорбируемости меди из реальных стоков для всех ионитов оказываются значительно ниже значений приводимых в литературе для модельных растворов, содержащих только ионы меди, за счет протекания конкурирующего ионого обмена с катионами натрия или ацетат-ионами, а также процессов комплексообразования меди с аммиаком и ацетат-ионами.
2.1.2 Сорбируемость меди на природных сорбентах: сапропелях, гуминовых кислотах, буром угле, опилках
Исследование состава и свойств бурых углей, сапропелей и торфов, а также выделенных из них гуминовых кислот привлекает большое внимание в связи с возможностями применения их в сельском хозяйстве, животноводстве, птицеводстве, рыбоводстве, ветеринарии, медицине и других отраслях. Имеющиеся в литературе данные касаются, прежде всего, способов выделения, состава и физико-химических свойств гуминовых кислот различного происхождения, в то время как их сорбционным и ионообменным свойствам посвящены лишь немногочисленные публикации.
Гуминовые кислоты, выделенные из Белгородского сапропеля сорбируют медь даже несколько хуже, чем исходный сапропель (сорбируемость составляет 3,0-3,2 и 3,6 мэкв/г соответственно при соотношении объема раствора к массе сорбента равном 600 см3/г и концентрации меди в исходном растворе 1мг/мл). Это доказывает, что в процессе сорбции меди участвуют активные центры, находящиеся как органической, так и в минеральной части сапропеля. Об этом свидетельствует и тот факт, что на минеральном сорбенте - горелых шахтных породах (при полном отсутствии органической массы) величины сорбции меди оказывались соизмеримыми со значениями сорбируемости на сапропелях и гуминовых кислотах.
В порядке уменьшения сорбируемости меди из сульфатных растворов с рН=4,5
сорбенты можно расположить в ряд: опилки > бурый уголь > сапропель ![]() горелая
шахтная порода. Интересно сравнить его с полученным нами ранее [4,5] в
статических условиях рядом сорбции меди из растворов с рН=12, моделирующих
медьсодержащие жидкие отходы производства синтетического каучука и содержащих
наряду с медью также аммиак, ионы натрия и ацетат-ионы: активированный уголь
> горелая шахтная порода
горелая
шахтная порода. Интересно сравнить его с полученным нами ранее [4,5] в
статических условиях рядом сорбции меди из растворов с рН=12, моделирующих
медьсодержащие жидкие отходы производства синтетического каучука и содержащих
наряду с медью также аммиак, ионы натрия и ацетат-ионы: активированный уголь
> горелая шахтная порода ![]() природный цеолит клиноптилолит
> бурый уголь > опилки. Очевидно, что изменение условий сорбции (наличие
в растворе аммиака и ацетат-ионов, образующих прочные комплексы с медью, а
также переход из кислой среды в щелочную) приводят не только к изменению
значений сорбируемости, но и меняют очередность сорбентов в ряду.
природный цеолит клиноптилолит
> бурый уголь > опилки. Очевидно, что изменение условий сорбции (наличие
в растворе аммиака и ацетат-ионов, образующих прочные комплексы с медью, а
также переход из кислой среды в щелочную) приводят не только к изменению
значений сорбируемости, но и меняют очередность сорбентов в ряду.
Таким образом, исследование сорбируемости меди на бурых углях и сапропелях указывает на возможность их применения до доочистки медьсодержащих промышленных стоков до санитарных норм. [1].
Сорбция меди возможна на многих природных твердых материалах, обладающих мелкодисперсной структурой и высокоразвитой поверхностью. Эффективными является применение активных углей разных марок. Окисление (чаще всего HNO3) за счет образования на их поверхности функциональных групп.
Активные угли имеют сравнительно низкую себестоимость по сравнению с ионитами. Они отличаются сильно пористой развитой структурой. Удельная поверхность пор достигает 1000-1800 м3/г для микропор размером 1-2 нм, для пор переходного размера (5-50 нм) - 100 м3/г, для микропор (>100 нм) - 1 м3/г. [2].
Путем последовательного метилирования карбоксильных и фенольных групп окисленного угля СКТ было найдено, что в поглощении, например, ионов кальция, свинца и меди принимают участие как карбоксильные, так и фенольные группы. После метилирования окисленного угля метилсульфатом его емкость уменьшилась на 25%, а метилирование метанолом привело к ее снижению на 75%, можно сделать вывод, что уголь, из которого последовательно связаны карбоксильные и фенольные группы. [3].
Находят применение бурые угли, как измельченные до определенной фракции, так и отделенные флотационным методом.
Измельченные до 0,1- 0,5 мм бурые и ископаемые угли, как правило, имеют окисленную углеродную поверхность и сорбируют медь после промывки 1-10 %-ным раствором кислоты, водной промывки и сушки. При кислотной обработке карбонизата, полученного обугливанием растений также может быть получен сорбент для тяжелых металлов. [4].
Наиболее перспективными твердыми поглотителями являются минеральные адсорбенты, на основе которых можно получать как очень дешевые адсорбенты одноразового действия, так и более дорогие поглотители с высокой механической прочностью, развитой пористой структурой и определенной химией поверхности. Интерес к модифицированным минеральным сорбентам вызван их специфическими свойствами: неорганический носитель придает сорбенту такие свойства, как высокая скорость установления равновесия (в случае микропористых сорбентов), химическая устойчивость к агрессивным средам, механическая прочность; модификатор обеспечивает селективность и полноту связывания ионов.
Существуют литературные данные об исследовании по модификации микропористого алюмосиликатного материала на основе горелой породы с использованием растворов гидроксида калия. [5].
В качестве носителя для получения модифицированного сорбента была использована горелая порода месторождения “Дальние Горы” г. Киселевска, имеющая следующий состав, %: SiO2 – 68,2; Al2O3 - 21,5; Fe2O3 - 4,7; остальное - 5,6 и образующаяся в результате пожара вызванного самовозгоранием угольных терриконов. [6].
Сорбцию меди, кадмия и свинца изучали в статических условиях из растворов их солей с концентрацией 103М. Количество сорбированных ионов рассчитывали по формуле:
![]() ,
мг/мл
,
мг/мл
С целью перевода испытуемого сорбента в модифицированную форму,
позволяющую повысить емкость природного образца, горелую породу обрабатывали
растворами щелочи, затем отмывали дистиллированной водой до нейтрального
значения pH и проводили сорбцию металлов при нормальных
условиях. В процессе модификации значения pH
варьировались от 8 до 14. Эксперимент проводили при температуре 20С и в
интервале концентраций от 10-3 до 3,1![]() 10-5М. В результате
исследования были получены следующие результаты:
10-5М. В результате
исследования были получены следующие результаты:
Результаты сорбируемости меди, свинца и кадмия Таблица1
| Сорбируемый Металл | Количество сорбированных ионов,А, мг/мл | |
| Немодиф. | Модиф. | |
| Медь | 10,4 | 14,2 |
| Свинец | 32,6 | 45,5 |
| Кадмий | 17,94 | 19,95 |
По мнению авторов, изученные сорбенты (модифицированная и немодифицированная) порода обладают значительной сорбционной емкостью, что позволяет использовать эти материалы в технологии для доочистки воды. [6].
2.2. Гуминовые кислоты
2.2.1 Методы извлечения и структура гуминовых кислот
2.2.1.1 Гуминовые кислоты сапропелей
ГК сапропелей — вещества, извлекаемые растворами щелочей, представляют большой интерес в научном и практическом плане. Содержание гуминовых веществ изменяется в пределах 17-62%, причем они более чем наполовину состоят их гуминовых кислот. ГК сапропелей отличаются от торфяных и угольных даже по внешним признакам, поэтому некоторые исследователи называют их "белым гумусом". В составе сапропелевых ГК больше водорода и азота, что связано с особенностями исходного биологического материала, обогащенного белковыми и жировыми веществами. Аминокислоты входят как непременный компонент во все гуминовые и фульвокислоты. Аминокислота, непосредственно связанная с фенольными кольцом, не отщепляются при гидролизе при обычных условиях, что говорит о структурной роли аминокислот в построении гуминовых веществ. Другой источник азота – порфирины. Их особенность – содержание пятичленных пиррольных циклов, которые могут участвовать в гумификации. Сочетанием химических и инструментальных методов исследования было показано, что гуминовые кислоты сапропелей, в отличие от ГК почв, торфов и углей, представлены в основном гидролизуемым полипептидно-углеводным комплексом (16 аминокислот и 5 углеводов (в сочетании с соединениями жирного ряда при малом количестве простых ароматических единиц.
Гуминовые кислоты сапропелей – это смесь кислых веществ биохимического превращения исходной биомассы водоема, представляющую собой группу природных аморфных поликарбоновых кислот с разнообразным содержанием полифункциональных групп (аминовых, амидных, карбоксильных, карбонильных, фенольных гидроксилов), растворимых, в основном, в щелочных растворах и выпадающих в осадок при подкислении раствора (до рН=1) минеральными кислотами из-за угнетения диссоциации слабых органических кислот. Гуматы (соли ГК) щелочных металлов растворимы в воде, гуматы остальных металлов нерастворимы. ГК термически нестойки, в термическом интервале 100-200 0С они декарбоксилируются и теряют растворимость. Удельная поверхность ГК примерно 900 м2/г, что сравнимо с удельной поверхностью активированного угля. При высушивании – это аморфный (или псевдокристалический) порошок темно-коричневого или черного цвета. В связи с высоким содержанием алифатических структур молекулы ГК очень гидролизованы и удерживают при растворении большое количество (от 14 до 20 г/г) связанной воды, вследствие чего уже при конденсации 3-4% ГК в растворе система представляет собой пасту. С увеличением концентрации ГК стабильность раствора сохраняется при повышении реакции среды (рН) с 3,0 для 1%-ного раствора, 6,0 – для 2% раствора, 7,0 – для 3% - ного. При понижении рН растворы приобретают вид коллойдных систем. В кислой среде вместе с гуминовыми кислотами выпадают в осадок и гиматомелановые кислоты (ГМК). Они растворяются при обработке осадка этанолом, образуя вишнево-красный раствор. Долгое время гиматомелановые кислоты включали в группу ГК. Сейчас имеется достаточно информации для выделения ГМК в особую группу. Тем не менее, информация о ГМК сапропелей в литературе отсутствует. В работах Орлова можно найти информацию о ГМК почв. Все ГМК почв обеднены углеродом по сравнению с ГК. Это связано с повышенной долей водорода в молекулах ГМК.
Для изучения структурных особенностей ГК широко используются методы деструкции, по характеру воздействия подразделяющиеся на две группы: методы гидролиза, затрагивающие периферийную часть молекулы, и методы жесткой деструкции, разрушающие ядро. Выявлено,[8] что содержание растворимой фракции при гидролизе ГК 2%-ным раствором НС1 составляет 25-54% на 0В и является более высоким для ГС сапропелей слабопроточных водоемов с преобладанием водорослевых остатков. В гидролизатах идентифицированы моносахариды (глюкоза и галактоза) и дисахариды (сахароза, мальтоза и лактоза), а также 15 аминокислот.
ГК сапропелей характеризуются высокой зольностью, основу которой составляет кремнезем. Впрочем, кремний может входить и в состав органоминерального комплекса ГК, хотя главная часть SiO2, по-видимому, соизвлекается щелочным раствором вместе с ГК. Минеральные компоненты ГК представлены алюминатами, силикатами, высокодисперсными легкопептизируемыми глинистыми минералами.
Для ГК сапропелей характерно взаимодействие с железом, кальцием, микроэлементами. Выявлен обменный характер связи кальция, магния и ряда микроэлементов с ГК. Доказаны две формы связи железа (ковалентная, ионная); при этом основная часть Fе (50-60%) и Са (50-70%) связана с высокомолекулярной фракцией ГК.
ГК склонны к образованию соединений с некоторыми минералами сапропелей (каолинитом и монтмориллонитом) адсорбционных соединений с карбонатами, в частности, с кальцитом и арагонитом, ингибируя тем самым процесс их осаждения. При этом важную роль при взаимодействии ОВ с поверхностью карбоната играют аминокислоты. На поверхности частиц СаСОз преимущественно адсорбируются лишь ГК и ФК, обогащенные дикарбоновыми кислотами (аспарагиновой и глутаминовой), тогда как на поверхности других минералов — кварца, глин — адсорбируются ГВ, содержащие аминокислоты основного характера (глицин, аланин).[7].
2.2.1.2 Гуминовые кислоты бурых углей
Исследование состава и свойств гуминовых кислот бурых углей и торфов приобретает все большее значение в связи с широким их применением в ряде отраслей народного хозяйства. Образец гуминовых кислот был приготовлен по стандартной методике из угля Хандинского месторождения с содержанием гуминовых кислот 52%. Метод приготовления ГК заключается в предварительной деминерализации пробы угля 5%-ным раствором НСl отмывке ее от ионов хлора и дальнейшей обработке угля 1%-ным NaOH, отделение твердой фазы и в последующей обработке раствором НСl (5%) для выделения свободных ГК в твердую фазу, повторном промывании ГК от ионов хлора и высушивании до постоянного веса.
Перед постановкой опытов образец ГК вывдерживали в термостате при 60 градусах в течение 1,5-2 ч.для удаления влаги. Опыты проводили в колбах (100мл) с притертой пробкой.Отношение адсорбента к раствору адсорбата составляло 1:25. По истечению заданного времени адсорбент отделяли от раствора фильтрованием через фильтр с синей лентой. В фильтрате определяли остаточную концентрацию металла атомно-абсорбционным методм. Проведенные исследования показали, что ионное равновесие наступает через 3 ч контакта фаз. В результате адсорбци понижается величина рН раствора вследсвтие обмена ионов металла с водородом карбоксильной группы.Адсорбция ионов металлов на ГК в сернокислой среде протекает несколько лучше, чем в солянокислой. [10].
2.2.2 Важнейшие функции гумусовы веществ в биосфере
Эти частные примеры приводят к необходимости выявления и формулирования важнейших функций гумусовых кислот в биосфере. В наиболее общей форме можно говорить о пяти важнейших функциях: аккумулятивной, транспортной, регуляторной, протекторной и физиологической. Их совокупность позволяет достаточно полно понять экологическую роль гумусовых веществ.
Аккумулятивная функция заключается в накоплении в почвах (и в других самостоятельных природных телах) в форме органических соединений углерода; азота, фосфора, других необходимых для жизнедеятельности элементов, включая микроэлементы. Аккумулятивную функцию не следует рассматривать, как пассивное складирование элементов питания, поскольку накопление может происходить и в почвенных растворах. Может быть, с этих позиций стоило бы выделить еще одну функцию – мобилизационную, но думается, что она перекрывается двумя другими – аккумулятивной и регуляторной.
Транспортная функция заключается в формировании геохимических потоков минеральных и органических веществ, преимущественно в водных средах за счет формирования устойчивых, но сравнительно легкорастворимых (или пептизируемых) комплексных соединений гумусовых кислот с катионами металлов, гидроксидами, некоторыми биоорганическими молекулами или образования адсорбционных соединений гумусовых кислот со слоистыми алюмосиликатами. Именно в таких формах, по-видимому, мигрирует в почвенном профиле и в ландшафтах преобладающая часть органических и неорганических соединений.
Регуляторная функция гумусовых кислот сложна и многопланова. К ней можно отнести:
1. Формирование почвенной структуры и водно-физических свойств почвы;
2. Регулирование равновесий в реакциях ионного обмена, кислотно-основных, окислительно-восстановительных процессах;
3. Регулирование условий минерального питания растений за счет влияния гумусовых веществ на растворимость минеральных компонентов и доступность живым организмам;
4. Регулирование теплового режима почв путем влияния на спектральную отражательную способность почв, на теплоемкость и теплопроводность почвенной массы;
5. Регулирование процессов внутрипочвенной дифференциации химического состава (внутри- и межгоризонтной).
Протекторная функция заключается в способности гумусовых веществ связывать в малоподвижные или труднодиссоциирующие соединения токсичные элементы или соединения. Выше говорилось, что гумусовые кислоты способны снять неблагоприятное влияние пестицидов на культурные растения. Экспериментально показано, что в почвах с большим запасом гуминовых кислот, гумина резко повышаются предельно допустимые концентрации тяжелых металлов; негативное влияние последних на растения проявляется при значительно более высоком содержании, чем в малогумусных почвах. Снимается и негативное влияние избыточных доз минеральных удобрений. В труднодоступные растениям формы соединений связываются не только тяжелые металлы, но и некоторые радиоактивные изотопы, например стронций. Протекторная функция охватывает не только системы почва – растение, но и другие компоненты ландшафта. Так, было показано, что почвы, особенно хорошо гумусированные, выполняют роль геохимического барьера и предупреждают поступление в грунтовые воды многих веществ. Почвенный покров может удерживать значительное количество катионов и анионов и тем самым поддерживать длительное время качество питьевых вод на хорошем уровне, даже в условиях техногенного загрязнения.
Физиологическая функция гумусовых веществ обсуждена выше. Отметим, что ее проявления весьма разнообразны, но изучены явно недостаточно.
При обсуждении гумусовых веществ в биосфере не были упомянуты такие важные аспекты, как их участие в формировании состава атмосферы, потока газов, направленного от почвы в атмосферу, с чем, в частности, может быть связано и появление парникового эффекта. Не упомянуты и многие другие важнейшие природные механизмы, но этому должна быть посвящена специальная монография. Здесь же важно подчеркнуть, что даже не полностью перечисленные функции гумусовых веществ отражают ведущую роль этих соединений во многих экологических связях и соотношениях и позволяют считать, что гуминовые кислоты – не случайный продукт «перегнивания» растительных и других остатков, а необходимый и неотъемлемый компонент системы почва – растение, сформировавшийся в результате совместной и единой эволюции живого и среды обитания, отражающий неразрывное единство этой системы.
Несмотря на недостаточную изученность гумусовых кислот в целом, за последние 10 – 20 лет появились новые материалы и накоплено много оригинальных данных, раскрывающих структуру ГК и ФК. Этому способствовало внедрение новых оригинальных методов для изучения гумусовых кислот. К таким методам относятся новые совершенные модификации ядерного магнитного резонанса, различных видов хроматографии, пиролитических методов, масс-спектрометрии. Существенно меняются представления в области молекулярных пераметров гумусовых кислот, молекулярно-массового распределения, формирования органо-минеральных соединений с участием гумусовых кислот. Все это требует дальнейшего обобщения и осмысления богатого, а зачастую и противоречивого экспериментального материала. [7]. По А.И. Горовой, физиологическая активность гумусовых веществ наиболее полно проявляет себя при неблагоприятных воздействиях. Физиологическая активность гумусовых веществ важна и интересна не только с агрономических или медицинских позиций. Это свойство заставляет задуматься о природе физиологического действия, а следовательно, о строении, молекулярных формулах гуминовых кислот (ГК) и фульвокислот (ФК). Высокая и многопрофильная активность ГК и ФК обусловлена прежде всего больших набором функциональных групп, причем не только таких обычных, как карбоксильные, фенольные, спиртовые, но также хинонные, аминные, амидные, способные к образованию электровалентных и ковалентных связей, внутрикомплексных соединений. Эти группы обеспечивают регулирование соотношения свободных и комплексных ионов как в почвенном растворе, так и во внутриклеточной среде. Разнообразие и сложность функций, несомненно, связаны с полихимизмом гумусовых кислот, молекулы которых различаются по размерам, а функциональные группы образуют спектр соединений, различающихся по прочности связей и ближайшему окружению удерживаемых катионов металлов. Полидисперсность и полифункциональность обеспечивают высокую буферность гумусовых систем в отношении кислотно-основных, окислительно-восстановительных и многих других реакций.
Такая система неизбежно должна активно регулировать геохимически потоки металлов и некоторых органических соединений в биосфере. Отталкиваясь от физиологической активности ГК и ФК, мы неизбежно приходим к представлениям о единстве живого и гумуса в понимании В.И. Вернадского, к положению о неизбежном формировании системы гумусовых веществ, обеспечивающей современные формы наземной жизни.
Функции органических соединений в почвах разнообразны, а зачастую и противоречивы. Низкомолекулярные вещества обычно легко доступны микроорганизмам и участвуют в процессах мобилизации минеральных составляющих почвы, извлекая многие элементы из труднорастворимых соединений. Гуминовые кислоты выполняют в значительной мере консервативную роль, придавая почвам устойчивые признаки, существующие длительное время и обусловливая их многие важнейшие свойства и функции: запас гумуса, емкость, емкость катионного обмена и пр.
Устойчивые запасы гумуса в почвах обусловлены, прежде всего, гуминовыми кислотами и гумином. Отсюда вытекает общая принципиальная установка: для накопления в почвах гумуса недостаточно привнесения в почву дополнительных количеств органического вещества, будь то в форме растительных остатков, навоза или других органических материалов. Одновременно с внесением должны быть созданы условия, обеспечивающие возможно полную гумификацию органических соединений, т.е. превращение их преимущественно в гуминовые кислоты или в гумин. Это обусловливает важнейшую задачу одновременного и сопряженного изучения строения гуминовых кислот и процесса гумификации. Сопряженный анализ позволяет не только точно и глубоко отвечать на теоретические вопросы, но и разрабатывать эффективные мелиоративные приемы с использованием органических удобрений.
Забота только об устойчивых, консервативных свойствах и фракциях почвенного гумуса явно недостаточна при решении задач повышения плодородия и биологической продуктивности.
Почвенная биота нуждается в постоянно пополняемом запасе лабильных органических веществ. Это достигается как поступлением «свежего» органического вещества, так и частичной мобилизацией запасов специфических гумусовых веществ. Процессы мобилизации могут осуществляться путем химического и ферментативного гидролиза, окисления или восстановления гумусовых веществ, их фотохимической деструкцией, что наиболее интенсивно протекает в поверхностном слое верхнего, гумусного горизонта. Мобилизация органического вещества может сопровождаться переходом соединений в химически и физиологически активные формы. Этим, в частности, можно объяснить несоответствие между стимулирующим эффектом малых доз препаратов гуматов натрия и высоким содержанием малоактивных гуминовых кислот и гуматов в почве. Было высказано предположение, что в процессе выделение из почв и подготовки препаратов гуминовых кислот и гуматов натрия молекулы ГК видоизменяются и переходят в активированную форму. В частности, в щелочной среде под воздействием кислорода воздуха повышается степень окисленности гуминовых кислот, повышается концентрация парамагнитных центров (свободных радикалов) и хиноидных групп, снижаются молекулярные массы. Особенно быстро и активно эти изменения происходят в условиях достаточного освещения, что говорит о фотохимической природе явления. В щелочной среде молекулы гуминовых кислот приобретают «раскрытую» конфигурацию, и тогда боковые цепи и функциональные группы получают больше возможностей для участия в различных реакциях.[7].
2.3 Методы определения меди
Медь относится к числу тех металлов, которые обладают хромофорными свойствами, поэтому среди многочисленных фотометрических методов определения меди имеются как методы, основанные на использовании окрашенных реагентов с хромофорными группами, так и методы, в которых применяют бесцветные реагенты. Большинство методов обладает высокой селективностью. Это подробно описанные ниже дитизоновый, дитиокарбаматный, купроиновый и купризоновый методы или метод с применением бис-(цикло-гексанон)оксалилдигидразона; наибольшей чувствительностью обладает дитизоновый метод. При помощи купризона определяют медь в водной фазе, остальные перечисленные методы относятся к экстракционно-фотометрическим.
2.3.1 Дитизоновый метод
В кислой среде и в присутствии избытка дитизона ионы меди образуют фиолетовый первичный дитизонат Cu(HDz)2 — устойчивое соединение, растворимое в неполярных растворителях (СС14, СНС13). Эта реакция положена в основу чувствительных фотометрических методов определения меди. В щелочной среде образуется менее интенсивно окрашенный желто-коричневый вторичный дитизонат CuDz, также растворимый в СС14 и СНС13. Вторичный дитизонат меди(П) может образоваться и в нейтральной или кислой среде при недостатке дитизона.
Молярный коэффициент поглощения раствора первичного дитизоната меди Cu(HDz)2 в четыреххлорпстом углероде равен 4,52*104 при 550 нм, удельное поглощение 0,71.
Реакция образования дитизоната меди протекает довольно медленно, поэтому при экстракции необходимо продолжительное встряхивание и рекомендуется применять механическую качалку. На скорость экстракции благоприятное действие оказывает увеличение концентрации дитизона в органической фазе и низкая кислотность водной среды.
Оптимальная скорость экстракции наблюдается в том случае, когда кислотность анализируемого раствора соответствует рН 1. При этой кислотности и применении 0,001—0,002.%-ного раствора дитизона еще не экстрагируются висмут и другие металлы, реагирующие с дитизоном. Вместе с медью дитизоном экстрагируются благородные металлы Pt, Pd, Au, Ag и Hg, реагирующие с дитизоном. Обычно содержание этих металлов (это чаще всего ртуть и серебро) в исследуемых растворах очень мало, намного меньше, чем содержание меди, и их можно удалить из экстракта в четыреххлористом углероде путем промывания раствором иодида кадия (например, 1%-ного), который дает с ними прочные иодидные комплексы. При наличии хлоридов в исследуемом растворе серебро не экстрагируется. Присутствие в растворе цитратов или тартратов несколько мешает экстракции меди дитизоном.
Удалить благородные металлы, мешающие определению меди, можно предварительной экстракцией их дитизоном из 1 н. раствора минеральной кислоты. Все благородные металлы, кроме палладия, образуют дитизонаты желто-оранжевого цвета, причем скорость экстракции их намного выше скорости экстракции меди. Исследуемый раствор извлекают небольшими порциями раствора дитизона в четыреххлористом углероде до тех пор, пока органический слой перестанет быстро приобретать желтый оттенок и после продолжительного встряхивания станет фиолетовым.
Для фотометрического определения меди можно использовать одноцветные или двуцветные дитизоновые методы. Вымывание свободного дитизона из экстракта при одноцветном методе следует проводить сильно разбавленным раствором аммиака и встряхивать недолго, чтобы избежать частичного превращения первичного дитизоната Cu(HDz)2 , во вторичный CuDz.
Дитизоновый метод применяют для определения меди в различных материалах, в частности в олове, титане и его сплавах, соединениях урана, биологических материалах.
2.3.2 Дитиокарбаматный метод
При добавлении к раствору (при рН 4 — 11), содержащему небольшое количество ионов меди(П), водного раствора диэтилдитиокарбамата натрия (Na-ДДТК, купраль, карбамат) раствор окрашивается в желто- коричневый цвет вследствие образования коллоидного раствора труднорастворимого комплекса меди. В этом комплексе соотношение Си : ДДТК равно 1:2. Медь соединяется с молекулами реагента посредством двух атомов серы, образуя редко встречающееся внутрикомплексное соединение с четырехчленными циклами. Добавка к раствору защитного коллоида (например, гуммиарабика) делает псевдораствор более устойчивым и позволяет фотометрически определять медь в водной фазе.
В более точном и более чувствительном, чаще используемом экстракционном варианте метода используется растворимость комплекса в органических растворителях, например четыреххлористом углероде, хлороформе, трихлор-этилене, амилацетате, изоамиловом спирте. Экстракция карбамата меди протекает легко, и полученные растворы довольно устойчивы.
Молярный коэффициент погашения раствора комплекса в четыреххлористом углероде при макс = 436 нм составляет 1,4*104 (удельное поглощение 0,22).
Определению меди при помощи диэтилдитиокарбамата натрия мешают металлы, образующие окрашенные карбаматные комплексы, главным образом Fe, Bi, Mn, Ni, Co, Cr, Mo, U. Эффективным маскирующим веществом, значительно повышающим селективность метода, является комплексон III. В тартратной или цитратной среде при рН 8—9 этот реагент маскирует Fe, Mn, Ni, Со, а также Cd, Pb, Zn и РЗЭ, образующие с диэтилдитиокарбаматом бесцветные комплексы. Среди тех металлов, которые дают окрашенные соединения с карбаматом, не маскируются, кроме меди, только висмут и таллий (Ш). После восстановления таллия до Т1(1) он уже не мешает определению меди. Из экстракта, содержащего карбамат меди и висмута, 5 н. раствором соляной кислоты можно извлечь висмут (встряхивать в течение 30 сек). Цианиды разлагают карбамат меди, а комплекс висмута остается неизмененным.
Определению меди, кроме цианидов, мешают также гипосульфиты, окислители и восстановители, которые могут восстановить Cu(ll) до Cu(I) или окислить диэтилдитиокарбамат натрия.
Определение меди усложняется также в связи с тем, что диэтилдитиокарбамат натрия нерастворим в органических растворителях. Кроме того, этот реагент довольно легко разлагается в кислых растворах на диэтиламин и сероуглерод.
Иногда вместо диэтилдитиокарбамата натрия используют диэтилдитио-карбамат диэтиламмония, который растворяется в хлороформе и устойчив к действию кислот.
Исследуемый раствор, содержащий Си(П), осаждают хлороформным раствором реагента.
Шедивец и Вашак избежали мешающего действия некоторых металлов (например, железа, марганца, цинка) на определение меди путем замены диэтилдитиокарбамата натрия карбаматом свинца. При встряхивании раствора этого реагента в хлороформе с водным раствором, содержащим медь, происходит реакция замещения. Этой реакции могут мешать металлы, комплексы которых более прочны, чем комплекс свинца; к числу таких металлов относятся Hg, Ag, Tl(III) и частично Bi. Креймер и Ломехов исследовали кинетику этой реакции.
Дибензилдитиокарбамат цинка менее селективен, чем диэтилдитиокарбамат свинца, но более устойчив в сильно кислой среде, он растворяется в четыреххлористом углероде и хлороформе. С помощью этого реагента можно экстрагировать медь из 1—2 н. соляной или серной кислоты.
Кроме указанных дитиокарбаматов для фотометрического определения меди рекомендуют также пирролидиндитиокарбамат натрия, пиперазин-бис-(дитиокарбамат) натрия и диэтанолдитиокарбамат калия.
Диэтилдитиокарбамат натрия используют для определения меди в цинке, кадмии, свинце, сурьме, титане и цирконии и других металлах, графите, органических соединениях, нефти, сточных водах, воде, почве и растительных материалах.
Метод с применением диэтилдитиокарбамата свинца используют для определения меди в различных металлах, растворах никеля и кобальта и воде.
Дибензилдитиокарбамат цинка нашел применение при определении меди в органических соединениях, пищевых продуктах, растительных материалах, воде и фосфатах.
2.3.3 Купроиновый, неокупроиновый и батокупроиновый методы
Купроин (2,2'-дихинолил), неокупроин (2,9-диметил-1,10-фенантролин) и батокупроин (2,9-диметил-4,7-дифенил-1,10-фенантролин) являются производными 2,2'-дипиридила и 1,10-фенантролина. Эти реагенты образуют с медью(1) окрашенные катионные комплексы. Эти реагенты содержат специфическую для меди(1) группировку, которая характеризуется наличием заместителей у атомов углерода, соседних с атомами азота.
Указанные методы специфичны для меди, но обладают сравнительно невысокой чувствительностью, особенно метод с купроином.
Хост и сотр. обстоятельно разработали условия экстракционно-фотометрического определения меди(1) при помощи купроина. Для экстракции комплекса меди из водного раствора пригодны в первую очередь амиловый и н-гексиловый спирты. В исследуемый раствор вносят восстановитель, чаще всего NH2OH-HCI, устанавливают оптимальное значение рН (в области 4—7) и встряхивают раствор с бесцветным раствором купроина в изоамиловом спирте. Поскольку коэффициент распределения высок (выше 103), часто проводят извлечение только одной порцией раствора купроина.
Из других катионов только Ti3+ дает с купроином зеленоватую окраску, которая значительно слабее по сравнению с пурпурной окраской медного комплекса. Из анионов, определению меди мешают цианиды, гипосульфиты, оксалаты и комплексон III.
Хакет добавляет к исследуемому раствору купроин в .метанольном растворе, а экстрагирует комплекс хлороформом.
3.Экспериментальная часть
3.1 Пробоотбор
3.1.1 Бурый уголь и минеральный сорбент (горелая порода шахтных выработок)
Были использовали бурый уголь и минеральный сорбент. Образцы шахтных пород отбирались на шахтах Тульской области ( в соответствии с ГОСТом): Васильевская (Киреевский район, поселок Бородинский); Подмосковная (Веневский район, поселок Грицово); Бельковская (Веневский район, поселок Бельково).
3.1.2 Сапропель
Объект исследования – сапропель (Белгородская область. Красногвардейский район река Тихая Сосна.) Отбор пробы производился по гостовской методике с поверхности залежи сапропеля по 5 л после спуска озера в 10 точках. Река Тихая Сосна берет начало на южных склонах Среднерусской возвышенности (Волоконский район) и несет свои воды по Красногвардейскому, Красненскому и Алексеевскому районам, впадая в Дон. Общая длина реки 161 км, в пределах Белгородской области - 105 км, ширина от 10 до 50 м, пойма большей частью луговая, частично заболоченная. В пойме и по берегам преобладают лиственные леса из дуба - черешчатого, березы, сосны обыкновенной. По левому берегу распространена луговая растительность, основу которой составляют злаковые, бобовые, осоки, подмарейник настоящий, тысячелистник, клевер горный. На реке Тихая Сосна в Красногвардейском районе, находится пойменное озеро-старица. Прибрежная зона озера покрыта тростником, кувшинками, рдестом, элодеей, а на поверхности в большом количестве растет ряска. Данное озеро относится к дистрофным озерам из-за ежегодного накопления в ложе органических остатков.
3.2 Подготовка сорбентов к работе
3.2.1 Бурый уголь
Бурый уголь, измельчали в шаровой мельнице, просеивали через сита c определенным размером отверстий и высушивали до постоянной массы. Для экспериментов брали фракцию с размером частиц 0,5-2 мм.
3.2.2 Сапропель
Пробы усреднялись. Сушка сапропеля производилась на воздухе при комнатной температуре. Измельчали сапропель в мельнице.
3.2.3 Выделение гуминовых кислот
Гуминовые кислоты (ГК) выделяли из деминерализованного сапропеля обработкой 2- и 12%- ными растворами HCl и 0,1 н водным раствором NaOH: одна порция (ГК 1) при комнатной температуре, другая (ГК 2) – при температуре кипения водяной бани; продолжительность выделения в обоих случаях составляла 2 часа. Данную операцию повторяли многократно (6 – 8 раз) до полного выщелачивания ГК. Раствор гуматов затем разлагали 5 %-ным раствором HCl. Выпавший осадок ГК отфильтровывали через взвешенный фильтр «синяя лента», тщательно отмывали дистиллированной водой, ставили на 24 часа на диализ, сушили в сушильном шкафу при t=40 0С и взвешивали.
3.2.4 Горелая порода шахтных выработок
Навеску породы (5 г) промывали дистиллированной водой, удаляя мелкие частицы флотационным методом.
3.2.5 Горелая порода шахтных выработок, модифицированная 5 % -м раствором NaOH
Навеску породы массой 5г, помещали в фарфоровую чашку и заливали 5 % -м раствором NaOH и выдерживали на кипящей водяной бане 30 мин. Модифицированную породу промывали дистиллированной водой, до нейтральной среды по универсальному индикатору, при этом, отделяя мелкие частицы флотационным методом.
3.3 Характеристика сорбентов
3.3.1 Элементный анализ
Элементный анализ выполнялся на автоматическом анализаторе (фирмы «Карло Эрба», модель 1100, Италия).
Условия: температура в реакторе сжигания 1100С; наполнитель – Cr2O3/CuO; газ-носитель – He. Температура в восстановительном реакторе 650С; наполнитель – Cu - стружка. Температура хроматографической колонки - 127С; стационарная твердая фаза – хромосорб-102; детектор – катарометр по теплопроводности. Окислитель – AgMnO4; стандарт – 9-нитроантрацен.
3.3.2 Технически характеристики
3.3.2.1 Методика определения зольности
Предварительно взвешенные тигли прокаливали в муфельной печи при 800 0С в течение 1,5 часов. Затем охлаждали в эксикаторе, взвешивали и снова прокаливали в муфельной печи в течение 30 минут, охлаждали и взвешивали. Далее брали навеску образца (1,5г краснодарского сапропеля и бурого угля), вносили в тигель и помещали в муфельную печь на 1,5 часа при температуре 800 0С, охлаждали и взвешивали. Затем в течение 30 минут снова прокаливали, доводили до постоянной массы и взвешивали.
3.3.2.2 Методика определения влажности
Предварительно взвешенные тигли прокаливали в муфельной печи при 800 0С в течение 1,5 часов. Затем охлаждали в эксикаторе, взвешивали и снова прокаливали в муфельной печи в течение 30 минут, охлаждали и взвешивали. Далее брали навеску образца (1,5г краснодарского сапропеля и бурого угля), вносили в тигель и помещали в сушильный шкаф на 1,5 часа при температуре 110 0С, охлаждали и взвешивали. Затем в течение 30 минут снова прокаливали, доводили до постоянной массы и взвешивали.
3.3 Методика определения содержания меди спектрофотометрически
Фотометрическое определение меди проводили на фотоэлектрокалориметре КФК-3.
Для построения
градуировочного графика готовили 14 стандартных растворов, содержащих 0,5, 1,5,
2,5, 3,5, 5,5, 6,5, 8,5, 9,5, 10,5, 12,5, 13,5, 16,5, 17,5, 18,5 мг меди в 25 см3
раствора. Для этого в мерные колбы вместимостью 25 см3 вносили
расчетный объем рабочего раствора с концентрацией 1 мг/мл, добавляли в каждую
колбу 5 см3 5% -ного раствора аммиака и доводили объёмы колб до
метки дистиллированной водой. Для приготовления раствора сравнения в колбу на
25 см3 приливали 5 см3 5% - ного раствора аммиака и
доводили до метки дистиллированной водой. Все приготовленные стандартные
растворы фотометрировали при ![]() относительно раствора сравнения.
На основании полученных результатов строили градуировочный график в
координатах: оптическая плотность от концентрации меди (рис. 1). Для выбора
оптимальной длины волны строили спектральную характеристику самого
концентрированного стандартного раствора определяя оптическую плотность при
разных длинах волн.
относительно раствора сравнения.
На основании полученных результатов строили градуировочный график в
координатах: оптическая плотность от концентрации меди (рис. 1). Для выбора
оптимальной длины волны строили спектральную характеристику самого
концентрированного стандартного раствора определяя оптическую плотность при
разных длинах волн.
Для выбора оптимальной длины волны строили спектральную характеристику самого концентрированного стандартного раствора определяя оптическую плотность при разных длинах волн.
К анализируемому раствору приливали 1 см 3 раствора HNO3 (1:1), доводили pH до 8-9 растворами натриевой щелочи или серной кислоты, приливали 10 см3 раствора аммиака и доводили объём до 50 см3 дистиллированной водой. Подготовленную пробу фотометрировали относительно раствора сравнения, пользуясь градуировочным графиком, находили содержание меди в анализируемом растворе.
3.4 Определение сорбируемости меди в статических условиях
В коническую колбу помещали навеску (0,5 или 2 г) сорбента и 250 см3 исследуемого раствора. Полученную смесь перемешивали в аппарате для встряхивания 1-2 часа. Через каждые 10 мин отбирали пробы раствора(2 см3) для анализа. Исследуемую пробу вместе с сорбентом центрифугировали до просветления раствора. После чего раствор переносили в колбу на 25 см3 и проводили фотоколориметрический анализ на содержание меди раствора (методика 1.4.). Расчет величин сорбируемости меди проводили по формуле:
![]() (1)
(1)
где Г - сорбируемость меди, мгэкв/г
С0-концентрация меди в исходном растворе, мг/мл
С – равновесная концентрация меди, мг/мл
V – объем исходного медьсодержащего раствора, мл
m – навеска сорбента, г
ЭCu – эквивалент меди, =32г/экв
4. Результаты экспериментов и их обсуждение
4.1 Градуировачный график для определения содержания меди
4.1.1 Построение спектральной характеристики аммиаката меди
Для выбора оптимальной длины волны строили спектральную характеристику, для этого измеряли оптическую плотность самого концентрированного из серии стандартных растворов при различных светофильтрах (длинах волн).
Спектральная характеристика аммиаката меди Таблица 2
| ,нм | 308,8 | 350,0 | 400,0 | 450,0 | 500,0 | 520,0 | 540,0 | 560,0 |
| А | 0,070 | 0,145 | 0,040 | 0,042 | 0,286 | 0,439 | 0,614 | 0,754 |
| ,нм | 580,0 | 600,0 | 650,0 | 700,0 | 750,0 | 800,0 | 850,0 | 900,0 |
| А | 0,854 | 0,888 | 0,820 | 0,613 | 0,398 | 0,244 | 0,158 | 0,106 |
На основании полученных данных рабочая волна - 600,0 нм.
4.1.2 Построение градуировачного графика
На основании измеренной оптической плотности 14 стандартных образцов (табл.3) был построен градуировочный график (рис.1).
Данные для построения градуировочного графика Таблица 3
| Содержание меди в 50 мл раствора, мг | Концентрация меди, мг/мл |
Оптическая плотность |
|||
| А1 | А2 | А3 | А’ | ||
| 0,5 | 0,02 | 0,050 | 0,050 | 0,050 | 0,050 |
| 1,5 | 0,06 | 0,088 | 0,092 | 0,092 | 0,0907 |
| 2,5 | 0,1 | 0,153 | 0,156 | 0,155 | 0,155 |
| 3,5 | 0,14 | 0,217 | 0,217 | 0,216 | 0,217 |
| 5,5 | 0,22 | 0,324 | 0,323 | 0,324 | 0,324 |
| 6,5 | 0,26 | 0,392 | 0,388 | 0,385 | 0,392 |
| 8,5 | 0,34 | 0,502 | 0,500 | 0,501 | 0,501 |
| 9,5 | 0,38 | 0,555 | 0,554 | 0,553 | 0,554 |
| 10,5 | 0,42 | 0,611 | 0,611 | 0,611 | 0,611 |
| 12,5 | 0,5 | 0,691 | 0,693 | 0,690 | 0,691 |
| 13,5 | 0,54 | 0,734 | 0,734 | 0,733 | 0,734 |
| 16,5 | 0,66 | 0,867 | 0,867 | 0,866 | 0,867 |
| 17,5 | 0,7 | 0,893 | 0,903 | 0,895 | 0,897 |
| 18,5 | 0,74 | 0,933 | 0,930 | 0,934 | 0,932 |

Рисунок 1 Градуировачный график для определения концентрации меди
4.1.3 Статистическая обработка результатов линейной регрессии.
Для построения графика использовали программу Microsoft Excel. Для расчета коэффициентов a и b в линейном уравнении использовали расчет с помощью программ Microsoft Excel, Sigma Plot 2000, а также по формулам:
y = a + bx
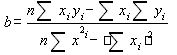
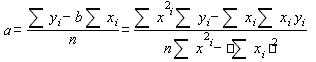
![]()
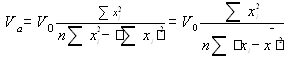
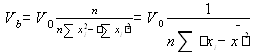
![]()
![]()
![]()
![]()
![]()
где Р- обычно принимают равным 0,95
![]()
Значения для статистической обработки данных Таблица 4
|
xi |
xi2 |
yi |
yi2 |
xiyi |
| 0,02 | 0,0004 | 0,050 | 0,0025 | 0,0010 |
| 0,06 | 0,0036 | 0,0907 | 0,0082 | 0,0054 |
| 0,1 | 0,0100 | 0,155 | 0,0240 | 0,0155 |
| 0,14 | 0,0196 | 0,217 | 0,0471 | 0,0304 |
| 0,22 | 0,0484 | 0,324 | 0,1050 | 0,0713 |
| 0,26 | 0,0676 | 0,392 | 0,1082 | 0,0855 |
| 0,34 | 0,1156 | 0,501 | 0,2540 | 0,1703 |
| 0,38 | 0,1444 | 0,554 | 0,3069 | 0,2105 |
| 0,42 | 0,1764 | 0,611 | 0,3733 | 0,2566 |
| 0,5 | 0,2500 | 0,691 | 0,4775 | 0,3455 |
| 0,54 | 0,2916 | 0,734 | 0,5388 | 0,3964 |
| 0,66 | 0,4356 | 0,867 | 0,7517 | 0,5722 |
| 0,7 | 0,4900 | 0,897 | 0,8046 | 0,6279 |
| 0,74 | 0,5476 | 0,932 | 0,8686 | 0,6897 |
|
|
|
|
|
|
Ручная и машинная статистическая обработка данных приводит к коэффициентам линейной регрессии:
Результаты статистической обработки линейной регрессии:
y = a + bx
Таблица 5
| Обработка результатов | параметры | ||||
| Коэфф. корреляции | а+a | b+b |
Sa |
Sb |
|
| По формулам | 0,04+0,07 | 1,3+0,1 | 0,0323 |
0,01478 |
|
| Microsoft Excel | 0,9961 | 0,04 | 1,3 | ||
| Sigma Plot 2000 | 0,9961 | 0,04+0,1 | 1,3+0,5 | 0,0323 | 0,0139 |
Коэффициент корреляции составляет 0,9961, что свидетельствует о том, что зависимость между x и y с достаточной вероятностью может быть описана в параметрах линейной регрессии.
4.2 Характеристика бурого угля и сапропелей
4.2.1 Технические характеристики
Были доведены до постоянной массы бурой уголь и сапропели (белгородский и краснодарский). По методике, проведенной в соответствии с ГОСТами: ГОСТ 11022-90, ГОСТ 11306-83, была определена зольность бурого угля и сапропелей и влажность (определена в соответствии с ГОСТом 11305-83. Данные представлены в таблице 6.
Зольность и влажность бурого угля и сапропелей Таблица 6
| Влажность, % | Зольность, % | Органическое вещество, % | |
| Бурый уголь | 6,9±0,2 | 0,1793±0,0009 | 99,8±0,2 |
| Сапропель (Белгород) | 3,9±0,1 | 82,8±0,0 | 13,2±0,1 |
| Сапропель (Краснодар) | 0,023±0,004 | 84,0±0,2 | 16,0±0,2 |
4.2.2 Элементный анализ
Проводили анализ исходных образцов (бурого угля и сапропелей) на содержание углерода, азота и водорода по методу органического анализа. Результаты анализа представлены в таблице 7.
Элементный анализ образцов Таблица 7
| Сорбент | Исходная навеска, масс. % daf | ОМ, масс. % | ||||||
| С | Н | N | С | H | N | O+S | H/C | |
| Бурый уголь | 50,0 | 4,0 | 1,4 | 66,4 | 0,6 | 1,9 | 31,1 | 0,01 |
| Сапропель (Белгород) | 4,6 | 5,1 | 4,0 | 64,7 | 5,1 | 4,0 | 26,2 | 0,08 |
| Сапропель (Краснодар) | 3,9 | 0,7 | 0,3 | 28,5 | 0,6 | 1,8 | 69,1 | 0,02 |
4.3 Выделение и характеристики гуминовых кислот
4.3.1 Выделение гуминовых кислот
Методика выделение гуминовых кислот описана в экспериментальной части в пункте [2.3.]. Выход ГК представлен в таблице 9:
Выход гуминовых кислот Таблица 9
| Название образца | Выход, мас.% ОМ |
| Гуминовые кислоты выделенные из сапропеля (Белгород) | 11,2 |
| Гуминовые кислоты выделенные из бурого угля | 54,9 |
4.3.2 Элементный анализ
По гостовским условиям был произведен элементный анализ на определение содержания углерода, азота и водорода гуминовых кислот, выделенных из сапропеля и бурого угля.
Элементный анализ образцов Таблиуа 9.1
| Сорбент | Исходная навеска, масс. % daf | ОМ, масс. % | ||||||
| С | H | N | С | H | N | O+S | H/C | |
| ГК из бурого угля | 38,4 | 3,4 | 1,0 | - | - | - | - | - |
| ГК из сапропеля (белг.) | 42,7 | 3,4 | 2,6 | 64,7 | 5,1 | 4,0 | 26,2 | 0,08 |
Исходя из результатов гуминовые кислоты, выделенные из бурого угля и белгородского сапропеля близки по элементному анализу.
4.3.3 ИК-спектры ГК
Проведен анализ снятия данных по ИК-спектроскопии гуминовых кислот, выделенных из бурого угля и белгородского сапропеля.
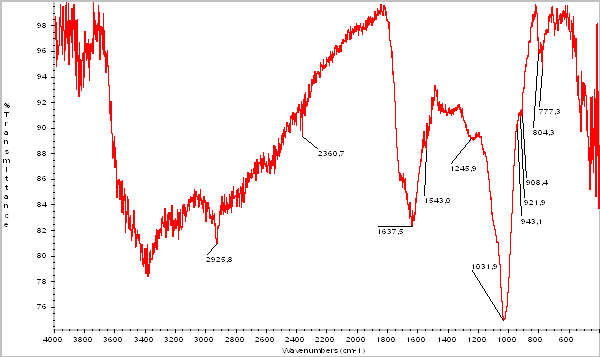
Рисунок 2.ИК-спектр гуминовых кислот, выделенных их сапропеля
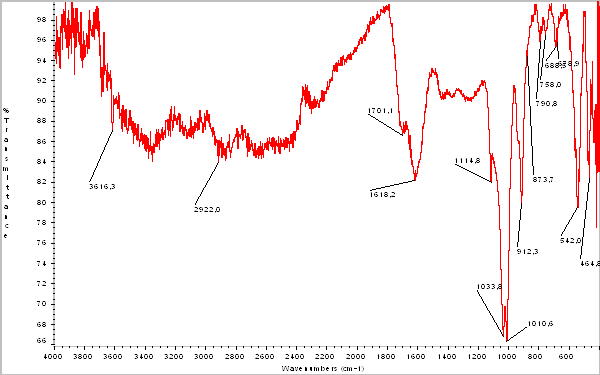
Рисунок 3.ИК-спектр гуминовых кислот, выделенных из бурого угля
Соотношение интенсивностей полос для гуминовых кислот Таблица 10
| Образец |
ICOOH (1700) |
IOH (3400) |
ICOOH/ IOH |
| Гуминовые кислоты из сапропеля (Белгород) | 85,297 | 78,142 | 1,0916 |
| Гуминовые кислоты из бурых углей | 86,584 | 85,444 | 1,0133 |
Из приведенных результатов видно, что отношение интенсивностей карбоксильных и гидроксильных групп гуминовых кислот, выделенных из белгородского сапропеля и бурого угля имеют близкие значения.
4.4 Изучение кинетики сорбции меди на буром угле и белгородском сапропеле
В качестве природных сорбентов были использованы бурый уголь и белгородский сапропель. Изучение зависимости изменения рН и концентрации раствора меди от времени проводили при контакте навеске сорбента (m=0,5;2 г сорбента) с концентрацией меди 1 мг/мл (Vр-ра=50;250 мл исходного раствора).
Результаты экспериментов представлены в таблицах и в виде кинетических кривых.
На основании полученных данных были рассчитаны величины сорбируемости меди (по формуле 1) в статических условиях на природных сорбентах.
Данные для построения кинетических кривых на буром угле при соотношение объема раствора к массе сорбента 250/2
Таблица 11
| № | Время, мин | pH | Оптическая плотность, A | Концентрация меди, С, мг/мл |
Сорбируемость, Г, мгэкв/г |
| 1. | 0 | 4,923 | 0,305 | 1,0549 | - |
| 2. | 5 | 4,507 | 0,230 | 0,7575 | 0,9473 |
| 3. | 10 | 4,263 | 0,167 | 0,5080 | 1,9219 |
| 4. | 15 | 4,090 | 0,123 | 0,3335 | 2,6035 |
| 5. | 20 | 4,020 | 0,097 | 0,2305 | 3,0059 |
| 6. | 25 | 4,010 | 0,084 | 0,1790 | 3,2070 |
| 7. | 60 | 4,010 | 0,078 | 0,1550 | 3,3008 |

Рисунок 4.Кинетическая кривая рН раствора меди на буром угле при соотношении объема раствора к массе сорбента 250/2
Рисунок 5.Кинетическая кривая сорбции меди на буром угле при соотношении объема раствора к массе сорбента 250/2
Данные для построения кинетических кривых на белгородском сапропеле при соотношении объема раствора к массе сорбента 250/0,5
Таблица 12
| № | Время, мин | pH | Оптическая плотность, A | Концентрация меди, С, мг/мл |
Сорбируемость, Г, мгэкв/г |
| 1. | 0 | 5,2300 | 0,407 | 1,0423 | - |
| 2. | 5 | 5,2012 | 0,278 | 0,9520 | 0,7500 |
| 3. | 10 | 5,1896 | 0,271 | 0,9240 | 1,1875 |
| 4. | 15 | 5,1835 | 0,268 | 0,9080 | 1,4375 |
| 5. | 20 | 5,1807 | 0,266 | 0,9005 | 1,5547 |
| 6. | 25 | 5,1803 | 0,265 | 0,8965 | 1,6172 |
| 7, | 30 | 5,1803 | 0,265 | 0,8965 | 1,6172 |
| 8. | 60 | 5,1805 | 0,265 | 0,8965 | 1,6172 |

Рисунок 6.Кинетическая кривая рН раствора меди на белгородском сапропеле при соотношении объема раствора к массе сорбента 250/0,5
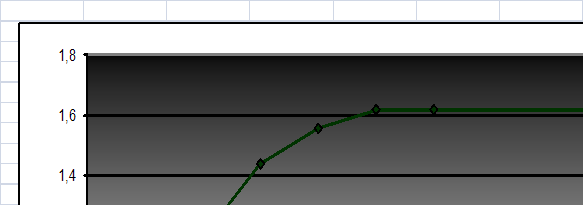
Рисунок 7.Кинетическая кривая сорбции меди на белгородском сапропеле при соотношении объема раствора к массе сорбента 250/0,5
Данные для построения кинетических кривых на белгородском сапропеле при соотношении объема раствора к массе сорбента 250/2
Таблица 13
| № | Время, мин | pH | Оптическая плотность, A | Концентрация меди, С, мг/мл |
Сорбируемость, Г, мгэкв/г |
| 1. | 0 | 4,920 | 0,322 | 1,1222 | - |
| 2. | 5 | 5,290 | 0,281 | 0,9597 | 0,1574 |
| 3. | 10 | 5,270 | 0,273 | 0,9240 | 0,2969 |
| 4. | 15 | 5,260 | 0,265 | 0,8965 | 0,4043 |
| 5. | 20 | 5,280 | 0,258 | 0,8725 | 0,4980 |
| 6. | 25 | 5,390 | 0,254 | 0,8527 | 0,5754 |
| 7. | 30 | 5,360 | 0,251 | 0,8408 | 0,6219 |
| 8. | 60 | 5,150 | 0,250 | 0,8370 | 0,6367 |

Рисунок 8. Кинетическая кривая рН раствора меди на белгородском сапропеле при соотношении объема рствора к массе сорбента 250/2
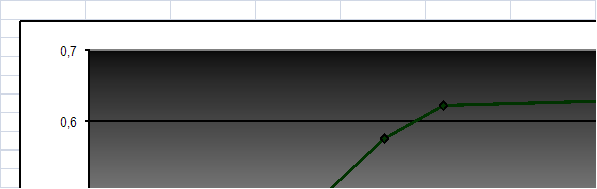
Рисунок 9. Кинетическая кривая сорбции меди на белгородском сапропеле при соотношении объема раствора к массе сорбента 250/2
На основе приведенных графиков можно сделать вывод о то, что рН уменьшается, сдвигается в кислую област. Во всех случаях равновесие устанавливается быстро за 20 – 30 минут. А сорбируемость увеличивается и достигает наибольшего значения также за 20 - 30 минут.
4.5 Изучение зависимости сорбции меди от концентрации исследуемого металла в растворе
В качестве природных сорбентов использовали бурый уголь, белгородский и краснодарский сапропели, гуминовые кислоты (ГК), выделенные из бурого угля и белгородского сапропеля, остатки бурого угля после экстракции ГК и остатки белгородского сапропеля после экстракции ГК.
Изучение зависимости изменения сорбции меди от концентрации проводили при контакте навеске сорбентов (m= 0,5 г природного сорбента) с концентрацией раствора меди 2 мг/мл (V=50 мл). Результаты экспериментов представлены в таблицах и в виде кинетических кривых.
4.5.1 Изотермы сорбции меди на природных сорбентах
Для анализа использовали следующие сорбенты: бурый уголь, белгородский и краснодарский сапропели и минеральную породу на основе горелой породы при соотношении объема раствора к массе навески 50/0,5.
Данные для сорбции меди на буром угле Таблица 14
| № п.п. |
C0, мг/мл |
Vал, мл |
А |
Сгр., мг/мл |
Сравн., мг/мл |
Г, мгэкв/г |
| 1. | 0,1076 | 20 | 0,058 | 0,0151 | 0,0378 | 0,2181 |
| 2. | 0,3229 | 20 | 0,122 | 0,0659 | 0,1648 | 0,4941 |
| 3. | 0,5382 | 10 | 0,113 | 0,0587 | 0,2935 | 0,7647 |
| 4. | 0,7535 | 10 | 0,148 | 0,0865 | 0,4325 | 1,0031 |
| 5. | 1,0764 | 5 | 0,125 | 0,0683 | 0,6830 | 1,2294 |
| 6. | 2,1529 | 5 | 0,253 | 0,1697 | 1,6970 | 1,4247 |
Данные для сорбции меди на белгородском сапропеле Таблица 15
| № п.п. |
C0, мг/мл |
Vал, мл |
А |
Сгр., мг/мл |
Са, мг/мл |
Г, мгэкв/г |
| 1. | 0,1076 | 20 | 0,046 | 0,0064 | 0,0080 | 0,2734 |
| 2. | 0,3229 | 20 | 0,085 | 0,0365 | 0,0913 | 0,7238 |
| 3. | 0,5382 | 20 | 0,127 | 0,0698 | 0,1745 | 1,1366 |
| 4. | 0,7535 | 20 | 0,171 | 0,1047 | 0,2618 | 1,5366 |
| 5. | 1,0764 | 10 | 0,150 | 0,0881 | 0,4405 | 1,9872 |
| 6. | 2,1529 | 5 | 0,219 | 0,1428 | 1,4280 | 2,2653 |
Данные для сорбции меди на краснодарском сапропеле Таблица 16
| № п.п. |
C0, мг/мл |
Vал, мл |
А |
Сгр., мг/мл |
Сравн., мг/мл |
Г, мг/г |
| 1. | 0,1076 | 20 | 0,040 | 0,0008 | 0,0020 | 0,3300 |
| 2. | 0,3229 | 20 | 0,042 | 0,0025 | 0,0063 | 0,9894 |
| 3. | 0,5382 | 10 | 0,050 | 0,0088 | 0,0220 | 1,6131 |
| 4. | 0,7535 | 10 | 0,056 | 0,0135 | 0,0339 | 2,2492 |
| 5. | 1,0764 | 10 | 0,076 | 0,0294 | 0,1470 | 2,9044 |
| 6. | 2,1529 | 5 | 0,158 | 0,0944 | 0,9440 | 3,7778 |
Данные для сорбции меди на минеральном сорбенте Таблица 17
| № п.п. |
C0, мг/мл |
Vал, мл |
А |
Сгр, мг/мл |
Сравн, мг/мл |
Г, мгэкв/г |
| 1. | 0,1076 | 20 | 0,087 | 0,0381 | 0,0953 | 0,0384 |
| 2. | 0,3229 | 20 | 0,181 | 0,1127 | 0,2818 | 0,1284 |
| 3. | 0,5382 | 10 | 0,158 | 0,0944 | 0,4720 | 0,2069 |
| 4. | 0,7535 | 10 | 0,208 | 0,1341 | 0,6705 | 0,2594 |
| 5. | 1,0764 | 5 | 0,162 | 0,0976 | 0,9760 | 0,3138 |
| 6. | 2,1529 | 5 | 0,293 | 0,2015 | 2,0150 | 0,4309 |
 Рисунок 10.Изотерма сорбции меди
на природных сорбентах
Рисунок 10.Изотерма сорбции меди
на природных сорбентах
По графику видно, что краснодарский сапропель сорбирует лучше, чем все остальные сорбенты. Это можно объяснить тем, что в краснодарском сапропеле намного больше минеральной части, чем в белгородском сапропеле. Бурый уголь представляет собой стоф из углерода, минеральная часть практически отсутствует. Поэтому он сорбирует хуже чем краснодарский и белгородский сапропель.
4.5.2 Изотермы сорбции меди на белгородском сапропеле, выделенных из этого же сапропеля гуминовых кислотах и остатке белгородского сапропеля после экстракции ГК.
Для исследования были использованы белгородский сапропель, выделенне из этого же сапропеля гуминовые кислоты и остаток белгородского сапропеля после экстракции ГК при соотношении объема раствора к массе сорбента50/0,5.
Данные для сорбции меди на ГК, выделенные из белгородского сапропеля Таблица 18
| № | Vал, мг/мл | А | То, мг/мл | Тгр, мг/мл | Та, мг/мл | Г, мэкв/г |
| 1 | 20 | 0,081 | 0,1076 | 0,0334 | 0,0835 | 0,0753 |
| 2 | 20 | 0,169 | 0,3229 | 0,1031 | 0,2578 | 0,2034 |
| 3 | 10 | 0,148 | 0,5382 | 0,0865 | 0,4325 | 0,3303 |
| 4 | 10 | 0,352 | 0,7535 | 0,2482 | 0,6205 | 0,4156 |
| 5 | 5 | 0,155 | 1,0764 | 0,0920 | 0,9200 | 0,4888 |
| 6 | 5 | 0,288 | 2,1529 | 0,1975 | 1,9750 | 0,5559 |
Данные для сорбции меди на остатке белгородского сапропеля после экстракции ГК Таблица 19
| № п.п. |
C0, мг/мл |
Vал, мл |
А |
Сгр, мг/мл |
Са, мг/мл |
Г, мгэкв/г |
| 1. | 0,1076 | 20 | 0,043 | 0,0033 | 0,0083 | 0,3103 |
| 2. | 0,3229 | 20 | 0,043 | 0,0032 | 0,0041 | 0,9962 |
| 3. | 0,5382 | 10 | 0,041 | 0,0017 | 0,0013 | 1,6778 |
| 4. | 0,7535 | 10 | 0,040 | 0,0009 | 0,0022 | 2,3178 |
| 5. | 1,0764 | 5 | 0,054 | 0,0120 | 0,1200 | 2,9888 |
| 6. | 2,1529 | 5 | 0,158 | 0,0944 | 0,9440 | 3,7778 |
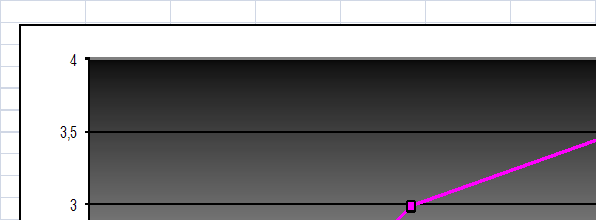
Рисунок11. Изотерма сорбции белгородского сапропеля, ГК, выделенных из белгородского сапропеля и остаток белгородского сапропеля после экстракции ГК
4.5.3 Изотерма сорбции меди на буром угле, гуминовых кислот, выделенных из него и остатке бурого угля после экстракции ГК.
Для анализа были использованы следующие сорбенты: бурый уголь, ГК, выделенные из него и остаток бурого угля после экстракции ГК.
Данные для сорбции меди на ГК, выделенные из бурого угля Таблица 20
| № | Vал., мл | Аср | То, мг/мл | Тгр, мг/мл | Та, мг/мл | Г, мэкв/г | |
| 1. | 15 | 0,075 | 0,1076 | 0,0286 | 0,0953 | 0,0384 | |
| 2. | 15 | 0,150 | 0,3229 | 0,0881 | 0,2937 | 0,0913 | |
| 3. | 15 | 0,226 | 0,5382 | 0,1483 | 0,4943 | 0,1372 | |
| 4. | 10 | 0,555 | 1,0764 | 0,4092 | 1,0230 | 0,1669 | |
| 5. | 5 | 0,569 | 2,1529 | 0,4203 | 2,1015 | 0,1895 | |
Данные для сорбции меди на остатке бурого угля после экстракции ГК Таблица 21
| № | Vал., мл | Аср | То, мг/мл | Тгр, мг/мл | Та, мг/мл | Г, мэкв/г |
| 1. | 20 | 0,067 | 0,1076 | 0,0223 | 0,0558 | 0,1619 |
| 2. | 20 | 0,135 | 0,3229 | 0,0762 | 0,1905 | 0,4138 |
| 3. | 20 | 0,201 | 0,5382 | 0,1285 | 0,3213 | 0,6778 |
| 4. | 20 | 0,271 | 0,7535 | 0,1840 | 0,4600 | 0,9172 |
| 5. | 10 | 0,223 | 1,0764 | 0,1460 | 0,7300 | 1,0825 |
| 6. | 5 | 0,260 | 2,1529 | 0,1753 | 1,7530 | 1,2497 |
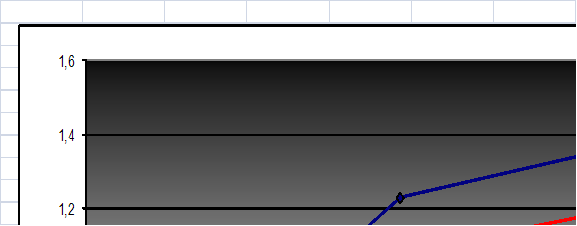
Рисунок 11. Изотерма сорбции бурого угля, ГК, выделенных из бурого угля и остаток бурого угля после экстракции ГК
ГК, выделенные из белгородского сапропеля сорбируют лучше, чем ГК, выделенные из бурого угля. Это связанно, с тем, что ГК, выделенные из бурого угля являются более окисленными, поэтому в них меньше содержится гидроксильных и больше хиноидных групп. Так же вследствие анализа было выяснено, что модификации бурого угля после обработки его щелочью не произошло и в результате бурый уголь сорбирует медь значительно лучше чем остаток бурого угля после экстракции ГК. Сорбция бурого угля равна сумме сорбций ГК, выделенных из него и остатка бурого угля после экстракции.
4.5.4 Изотерма сорбции меди на минеральном сорбенте (модифицированном и без обработки).
Для данной цели использовали минеральный сорбент на основе горелой породы без обработки и модифицированный.
Данные для сорбции меди на минеральном сорбенте Таблица 22
| № п.п. |
C0, мг/мл |
Vал, мл |
А |
Сгр, мг/мл |
Сравн, мг/мл |
Г, мгэкв/г |
| 1. | 0,1114 | 20 | 0,088 | 0,0389 | 0,0973 | 0,0442 |
| 2. | 0,3343 | 20 | 0,185 | 0,1174 | 0,2935 | 0,1275 |
| 3. | 0,5571 | 10 | 0,162 | 0,0976 | 0,4880 | 0,2159 |
| 4. | 0,7799 | 10 | 0,213 | 0,1380 | 0,6900 | 0,2809 |
| 5. | 1,1142 | 5 | 0,165 | 0,1000 | 1,0000 | 0,3569 |
| 6. | 2,2283 | 5 | 0,302 | 0,2086 | 2,0860 | 0,4447 |
Данные для сорбции меди на модифицированном минеральном сорбенте Таблица 23
| № п.п. |
C0, мг/мл |
Vал, мл |
А |
Сгр, мг/мл |
Сравн, мг/мл |
Г, мгэкв/г |
| 1. | 0,1114 | 20 | 0,080 | 0,0326 | 0,0815 | 0,0934 |
| 2. | 0,3343 | 20 | 0,175 | 0,1079 | 0,2698 | 0,2016 |
| 3. | 0,5571 | 10 | 0,156 | 0,0928 | 0,4640 | 0,2909 |
| 4. | 0,7799 | 10 | 0,206 | 0,1325 | 0,6625 | 0,3669 |
| 5. | 1,1142 | 5 | 0,162 | 0,0976 | 0,9760 | 0,4319 |
| 6. | 2,2283 | 5 | 0,298 | 0,2054 | 2,0542 | 0,5441 |
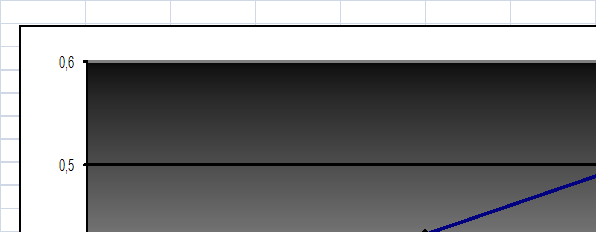
Рисунок 12.Изотерма сорбции минеральных сорбентов (модифицированный и без обработки)
После обработки минерального сорбента щелочью (в условиях аналогичных при выделении ГК) происходит увеличение сорбируемости меди на минеральном сорбенте, что подтверждает нашу гипотезу о увеличении величины сорбируемости при модифицировании за счет кипячения со щелочью минеральной части белгородского сапропеля.
5. Влияние природы сорбента на сорбируемость
Сорбируемость была исследована при одинаковых условиях при соотношении объема раствора к массе сорбента 50/0,5.
Данные величин сорбируемости
Ср-ра Cu2+=1 мг/мл, Vр-ра/mсорбента= 50/0,5
Таблица 24
| Сорбент | Сорбируемость, мгэкв/г |
| Сапропель (Краснодар) | 3,1053 |
| Сапропель (Белгород) | 3,0069 |
| Гуминовые кислоты (из сапропеля (Белгород)) | 2,8397 |
| Остаток сапропеля (Белгород) после выделения гуминовых кислот | 3,0991 |
| Бурый уголь | 2,9506 |
| Гуминовые кислоты (из бурого угля) | 2,8272 |
| Остаток бурого угля после выделения гуминовых кислот | 2,8641 |
| Минеральный сорбент | 2,2444 |
| Модиф. минеральный сорбент | 2,2819 |
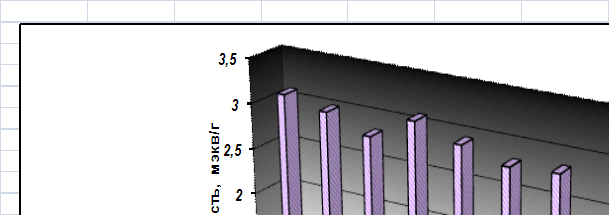
Рисунок 13.Сорбируемость природных сорбентов
Показатели данной диаграммы позволяют расположить сорбенты в ряд в порядке возрастания их сорбционных свойств:
ГК (выделенные из бурого угля)<минеральный сорбент<модифицированный минеральный сорбент<ГК (выделенные из белгородского сапропеля)<бурый уголь<остаток бурого угля после выделения ГК<остаток белгородского сапропеля после выделения ГК<белгородский сапропель<краснодарский сапропель.
6 Выводы
· Бурый уголь, сапропели, а также гуминовые кислоты охарактеризованы методами элементного анализа и ИК-спектроксопией.
· Показано, что ГК, выделенные из бурого угля и сапропелей имеют близкие элементный состав и соотношение карбоксильных и гидроксильных групп и могут быть выделены: из бурого угля выход составляет 54,9%; из белгородского сапропеля выход составляет 11,2%.
· Изучение кинетических кривых рН(t) и Г(t) показало, что равновесие сорбции устанавливается за 20 – 30 минут.
· Изучение изотерм сорбции позволяет распределить сорбенты в ряд по увеличению сорбируемости:
ГК (выделенные из бурого угля)<минеральный сорбент<модифицированный минеральный сорбент<ГК (выделенные из белгородского сапропеля)<бурый уголь<остаток бурого угля после выделения ГК<остаток белгородского сапропеля после выделения ГК<белгородский сапропель<краснодарский сапропель.
7. Список литературы
[1]. Современные проблемы экологии и рационального природопользования в тульской области: Доклады 5-й региональной научно-практической конференции./Под редакцией Э.М. Соклова. – Тула: Изд-во ТулГУ, 2006. – 194с.
[2]. Аширов А. Ионообменная очистка сточных вод, растворов и газов. – Л.: Химия, 1983. – 296с.
[3]. Мелехова Н.И. Внутренние сырьевые ресурсы в агропромышленном комплексе. Демидовские чтения. Второй юбилейный выпуск. – Тула, 1996. – с.33-39.
[4]. Жуков А.И., Монгайт И.И., Родзиллер И.Д. Методы очистки производственных сточных вод. – М.: Стройиздат, 1977. С.84-85.
[5]. Вишнякова Л.Г., Мелехова Н.И. Применение медно – аммиачного раствора в качестве комплексного микроудобрения. Информационный листок. – Тула: ЦНИТИ, №84-89. – с.2-3.
[6]. М.И. Гельфман, Ю.В. Тарасова, Т.В. Шевченко. Химическая промышленность, 2002, №2 – с.20-26.
[7]. Орлов Д.С. Гумусовые кислоты почв и общая теория гумификации. М. Изд-во МГУ 1990г. – 325с.
[8]. Пунтус Ф.А., Бамбалов Н.Н., Смычкин Т.П. Исследование перефирической части гуминовых кислот, торфа и сапропелей.//Проблемы использования сапропелей в народном хозяйстве. – Минск: Наука и техника. 1976г. – с.115-122.
[9]. З. Марченко. Фотометрическое определение элементов. Изд-во «Мир» М.1971.
[10]. Вязова Н.Г., Крюкова В.Н., Латыше В.П. Сорбционные свойства гуминовых кислот. Химия твердого топлива №6 – 1999.