Рефераты по авиации и космонавтике
Рефераты по административному праву
Рефераты по безопасности жизнедеятельности
Рефераты по арбитражному процессу
Рефераты по архитектуре
Рефераты по астрономии
Рефераты по банковскому делу
Рефераты по сексологии
Рефераты по информатике программированию
Рефераты по биологии
Рефераты по экономике
Рефераты по москвоведению
Рефераты по экологии
Краткое содержание произведений
Рефераты по физкультуре и спорту
Топики по английскому языку
Рефераты по математике
Рефераты по музыке
Остальные рефераты
Рефераты по биржевому делу
Рефераты по ботанике и сельскому хозяйству
Рефераты по бухгалтерскому учету и аудиту
Рефераты по валютным отношениям
Рефераты по ветеринарии
Рефераты для военной кафедры
Рефераты по географии
Рефераты по геодезии
Рефераты по геологии
Рефераты по геополитике
Рефераты по государству и праву
Рефераты по гражданскому праву и процессу
Рефераты по кредитованию
Рефераты по естествознанию
Рефераты по истории техники
Рефераты по журналистике
Рефераты по зоологии
Рефераты по инвестициям
Рефераты по информатике
Исторические личности
Рефераты по кибернетике
Рефераты по коммуникации и связи
Рефераты по косметологии
Рефераты по криминалистике
Рефераты по криминологии
Рефераты по науке и технике
Рефераты по кулинарии
Рефераты по культурологии
Рефераты по авиации и космонавтике
Рефераты по административному праву
Рефераты по безопасности жизнедеятельности
Рефераты по арбитражному процессу
Рефераты по архитектуре
Рефераты по астрономии
Рефераты по банковскому делу
Рефераты по сексологии
Рефераты по информатике программированию
Рефераты по биологии
Рефераты по экономике
Рефераты по москвоведению
Рефераты по экологии
Краткое содержание произведений
Рефераты по физкультуре и спорту
Топики по английскому языку
Рефераты по математике
Рефераты по музыке
Остальные рефераты
Рефераты по биржевому делу
Рефераты по ботанике и сельскому хозяйству
Рефераты по бухгалтерскому учету и аудиту
Рефераты по валютным отношениям
Рефераты по ветеринарии
Рефераты для военной кафедры
Рефераты по географии
Рефераты по геодезии
Рефераты по геологии
Рефераты по геополитике
Рефераты по государству и праву
Рефераты по гражданскому праву и процессу
Рефераты по кредитованию
Рефераты по естествознанию
Рефераты по истории техники
Рефераты по журналистике
Рефераты по зоологии
Рефераты по инвестициям
Рефераты по информатике
Исторические личности
Рефераты по кибернетике
Рефераты по коммуникации и связи
Рефераты по косметологии
Рефераты по криминалистике
Рефераты по криминологии
Рефераты по науке и технике
Рефераты по кулинарии
Рефераты по культурологии
Реферат: Концептуальные уровни в познании веществ и химические системы
Реферат: Концептуальные уровни в познании веществ и химические системы
Содержание
Введение. 2
Состав вещества и химические системы.. 5
Полимеры и мономеры.. 6
Периодический закон Менделеева. 7
Вещества простые и сложные соединения. Понятие о качественном и количественном составе вещества. 9
Катализаторы и биокатализаторы.. 15
Невозможность классического описания поведения электронов в атоме. 16
Организация электронных состояний атома в электронных оболочках. 17
Дискретность электронных состояний в атоме. 18
Изотопы.. 23
Переход электронов между электронными состояниями как основные атомные процессы(возбуждение и ионизация) 24
Заключение. 26
Список литературы.. 27
В данной работе рассматривается тема "Концептуальные уровни в познании веществ и химические системы". Химию обычно рассматривали как науку о составе и качественном превращении различных веществ. В первое время именно по составу реагирующих веществ пытались объяснить свойства полученных новых веществ. Уже на этом этапе ученые встретились с огромными трудностями. Ведь для того чтобы понять, какие именно первоначальные элементы определяют свойства простых и сложных веществ, надо, во-первых, уметь различать простые и сложные вещества, а во-вторых, определить те элементы, от которых зависят их свойства. Между тем долгое время ученые считали, например, металлы сложными веществами, а об элементах существовали самые противоречивые представления. Поэтому, несмотря на обилие эмпирического материала о свойствах различных веществ и их соединений, особенностях протекания разнообразных реакций, в химии, по сути дела, до открытия в 1869 г. Периодической системы химических элементов Дмитрия Ивановича Менделеева (1834-1907) не существовало той объединяющей концепции, с помощью которой можно было бы объяснить весь накопленный фактический материал, а следовательно, представить все наличное знание как систему теоретической химии. Таким образом, систематизация химического знания - совсем недавнее свершение, потому актуальность данной темы не вызывает сомнений.
Цель работы - анализ концептуальных уровней в познании веществ.
Объект исследования - химические системы.
Было бы неправильно не учитывать той громадной исследовательской работы, которая привела к утверждению системного взгляда на химические знания. Уже с первых шагов химики на интуитивном и эмпирическом уровне поняли, что свойства простых веществ и химических соединений зависят от тех неизменных начал или носителей, которые впоследствии стали называть элементами. Выявление и анализ этих элементов, раскрытие связи между ними и свойствами веществ охватывает значительный период в истории химии, начиная от гипотезы Роберта Бойля (1627-1691) и кончая современными представлениями о химических элементах как разновидностях изотопов, т.е. атомов, обладающих одинаковым зарядом ядра и отличающихся по массе. Этот первый концептуальный уровень можно назвать исследованием различных свойств веществ в зависимости от их химического состава, определяемого их элементами. Здесь мы видим поразительную аналогию с той концепцией атомизма, о которой шла речь в предыдущей главе. Химики, как и физики, искали ту первоначальную основу или элемент, с помощью которых пытались объяснить свойства всех простых и сложных веществ.
Второй концептуальный уровень познания свойств связан с исследованием структуры, т.е. способа взаимодействия элементов веществ. Эксперимент и производственная практика убедительно доказывали, что свойства полученных в результате химических реакций веществ зависят не только от элементов, но и от взаимосвязи и взаимодействия элементов в процессе реакции. Именно поэтому в процессе познания и использования химических явлений необходимо было учитывать их структуру, т.е. характер взаимодействия составных элементов вещества.
Третий уровень познания представляет собой исследование внутренних механизмов и условий протекания химических процессов, таких, как температура, давление, скорость протекания реакций и некоторые другие. Все эти факторы оказывают громадное влияние на характер процессов и объем получаемых веществ, что имеет первостепенное значение для массового производства.
Наконец, четвертый концептуальный уровень является дальнейшим развитием предыдущего уровня, связанным с более глубоким изучением природы реагентов, участвующих в химических реакциях, а также применением катализаторов, значительно ускоряющих скорость их протекания. На этом уровне мы встречаемся уже с простейшими явлениями самоорганизации, изучаемыми синергетикой.
Задачи, решаемые в ходе работы:
- рассмотреть методы и концепции познания в химии;
- дать понятие состава вещества и химических систем;
- проанализировать изучение структуры веществ в рамках химической системы.
Рассмотрим подробнее концептуальные уровни в познании веществ и химические системы.
Состав вещества и химические системы
Химическая система – совокупность микро и макро количеств веществ, способных воздействием внешних факторов (условий) к превращениям с образованием новых химических соединений.
Веществом называется отдельный вид материи, обладающий при данных условиях определенными физическими свойствами. Примеры вещества: кислород, вода, железо.
Простейшим носителем химических свойств служит атом (в том числе ионизированный) - система, состоящая из ядра и движущихся вокруг него (в его электрическом поле) электронов. В результате химического взаимодействия атомов образуются молекулы (радикалы, ионы, атомные кристаллы) -системы, состоящие из нескольких ядер, в общем поле которых движутся электроны. При химическом взаимодействии молекул одна конфигурация ядер и электронов разрушается и образуется новая. Акт химического взаимодействия состоит в образовании новых электронных (молекулярных) орбиталей.
Молекулой по-прежнему называют наименьшую частицу вещества, способную определять его свойства и существовать самостоятельно. Но теперь в число молекул включают и такие квантово-ме-ханические системы, как ионные, атомные и металлические монокристаллы и полимеры, образованные за счет водородных связей. Поэтому некоторые неорганические вещества (оксиды, хлориды, сульфиды, нитриды металлов) относят к веществам молекулярного строения, не имеющим постоянного состава.
В настоящее время под химическим элементом понимают совокупность атомов с одинаковым зарядом ядра. Начало современному представлению о химическом элементе как о <простом теле> или как о пределе химического разложения вещества, переходящем без изменения их состава одного сложного тела в состав другого, первым положил Р. Бойль в середине XVII в. Химики того времени не знали ни одного химического элемента. Фосфор был открыт только в 1669 г., а потом повторно в 1680 г., кобальт - в 1735 г., никель - в 1751 г., водород - в 1766 г., фтор - в 1771 г., азот - в 1772 г., хлор и марганец - в 1774 г. Любопытно, что кислород был открыт одновременно в Швеции, Англии и Франции в 1772 - 1776 гг.
Полимеры - высокомолекулярные соединения, молекулы которых имеют линейное строение и состоят из большого числа повторяющихся комплексов. Полимеры - это гигантские химические молекулы, образуемые в результате последовательного присоединения к друг другу тысяч и десятков тысяч простых молекул , так называемых мономеров. В вытянутом состоянии такие молекулы представляют собой длинную нить толщиной в одну молекулу. Звенья полимерной цепи связаны очень прочно, поэтому полимеры очень прочные на разрыв. Максимальная прочность достигается когда все нити параллельны друг другу, обеспечивая равномерную нагрузку. Реализуется максимальная прочность путем вытягивания в нити. Чем больше длина молекулы, тем прочнее связь. В итоге получается, что мономеры - газы, а полимеры - твердые тела. Первые полимерные продукты были получены в конце 19 века, однако основные представления о свойствах и природе полимеров стали известны только к началу сороковых годов. Именно тогда сформировалось основное представление о синтезе полимеров, главное в котором - чистота исходных мономеров. Так как даже малые примеси приводят к прекращению процесса полимеризации. К началу сороковых годов были созданы основные полимерные вещества: полистирол, полихлорвинил, полиамиды, полиэфиры и так далее. В тридцатых годах под руководством С.В. Лебедева было начато производство синтетического каучука. В то же время были открыты кремнийорганические полимеры, которые являются хорошими диэлектриками
Мономе́р (с греч. mono "один" и meros "часть") — это небольшая молекула, которая может образовать химическую связь с другими мономерами и составить полимер.
Стоит отметить, что другие низкомолекулярные вещества принято называть димерами, тримерами, тетрамерами, пентамерами и т.д., если они, соответственно, состоят из 2, 3, 4, и 5-ти мономеров. Приставку олиго- (сахариды, меры, пептиды) добавляют в общем случае, когда полимер состоит из небольшого количества мономеров.
Мономеры могут быть как органическими, так и неорганическими.
Примерами органических мономеров могут служить молекулы углеводородов, такие, как алкены и арены. К примеру, полимеризация этена приводит к образованию такой широко известной пластмассы, как полиэтилен. Липиды также являются составленными из мономеров жирных кислот и глицерина. Также в промышленности широко используют акриловые мономеры — акриловую кислоту, акриламид.
В результате полимеризации природных мономеров — аминокислот, образуются белки. Мономеры глюкозы образуют различные полисахариды — гликоген, крахмал
Периодический закон Менделеева
В 1669 году Д. И. Менделеев сформулировал закон: Свойства простых тел, а также свойства и формы соединений находятся в периодической зависимости от величин атомных весов элементов. Расположив все известные в то время элементы в порядке возрастания относительных атомных масс, Менделеев наблюдал периодическое изменение их свойств. В настоящее время принята современная формулировка закона, учитывающая строение атома (неизвестное во время создания закона Д.И.Менделеева ):Свойства элементов, а также простых и сложных ими образуемых, находятся в периодической зависимости от заряда ядра атома.
Периодическая система является графическим выражением периодического закона. Существуют различные варианты отображения периодичности, однако наиболее удобной остается таблица, предложенная Д.И.Менделеевым.
Таблица состоит из 7 периодов (горизонтальные ряды элементов ) и 8 групп (вертикальные ряды элементов ).
Периоды 1-3 называются малыми, они состоят из одного ряда, в первом периоде только 2 элемента, во 2 и 3 - по 8 элементов. Периоды 4-7 называются большими, они состоят из 2 рядов. 7 период является незавершенным. В каждой группе элементов можно выделить 2 подгруппы - главную и побочную.
В малых периодах - 2 и 3 (в них находятся только элементы главных подгрупп ) - наиболее отчетливо видны закономерности , которые существуют и в больших периодах:
Каждый период начинается щелочным металлом и заканчивается инертным газом.
Слева направо, с ростом порядкого номера элементов:
Увеличивается эллектроотрицательность
Уменьшается атомный радиус
Ослабляются металлические (востановительные) свойства
Увеличивают неметаллические (окислительные) свойства
В главных подгруппах с увеличением порядкового номера элементов наблюдаются следующие закономерности:
Номер группы, как правило, указывает число электронов, которые могут участвовать в образовании химических связей. В этом — физический смысл номера группы.
Эллектроотрицательность уменьшается
атомный радиус увеличивается
металлические (восстановительные) свойства элементов усиливаются
неметаллические (окислительные) свойства ослабляются
Вещества простые и сложные соединения. Понятие о качественном и количественном составе вещества
Веществом называется отдельный вид материи, обладающий при данных условиях определенными физическими свойствами. Примеры вещества: кислород, вода, железо.
Чистое вещество всегда однородно, смеси же могут быть однородными и неоднородными. Однородными называются смеси, в которых ни непосредственно, ни при помощи микроскопа нельзя обнаружить частиц этих веществ вследствие ничтожно малой их величины. Такими смесями являются смеси газов, многие жидкости, некоторые сплавы. В неоднородных смесях неоднородность можно обнаружить при помощи микроскопа или даже невооруженным глазом. Примерами неоднородных смесей могут служить различные горные породы, почва, пыльный воздух, мутная вода. Кровь, например, тоже относится к неоднородным смесям, и при рассмотрении в микроскоп можно увидеть, что она состоит из бесцветной жидкости, в которой плавают красные и белые тельца.
Химическая промышленность выпускает химические продукты, которые также содержат какое-то количество примесей. Для указания степени их чистоты существуют специальные обозначения, или квалификация:
технический (техн);
чистый (ч.);
чистый для анализа (ч.д.а.);
химически чистый (х.ч.);
особо чистый (о.ч.).
Продукт с квалификацией «техн» обычно содержит значительное количество примесей, «ч.» — меньше, «ч.д.а.» — значительно меньше, «х.ч.» — меньше всего. С маркой «о.ч.» выпускаются лишь некоторые продукты. Допустимое содержание примесей в химическом продукте той или иной квалификации устанавливается государственными стандартами.
Ежедневно мы можем видеть, как вещества подвергаются различным изменениям, например, свинцовая пуля, ударившись о камень, нагревается так сильно, что свинец плавится, превращаясь в жидкость; стальной предмет, находящийся под действием влаги, покрывается ржавчиной; дрова в печи сгорают, оставляя кучку пепла, опавшие листья деревьев постепенно истлевают, превращаясь в перегной и т.д.
При плавлении свинцовой пули ее механическое движение переходит в тепловое, но этот переход не сопровождается химическим изменением свинца, так как твердый и жидкий свинец представляет одно и то же вещество. Но если тот же свинец в результате длительного нагревания на воздухе превращается в оксид свинца, то получается новое вещество с совершенно иными свойствами. Точно так же при гниении листьев, появлении ржавчины на стали, горении дров образуются совершенно новые вещества.
Химическими называются явления, при которых из одних веществ образуются другие, новые вещества, а наука, изучающая превращение вещества, называется химией. Она изучает состав и строение веществ, зависимость их свойств от состава и строения веществ, условия и пути превращения одних веществ в другие.
Химические изменения всегда сопровождаются изменениями физическими, поэтому химия и физика тесно связаны. Химия также тесно связана с биологией, так как биологические процессы сопровождаются непрерывными химическими превращениями. Однако каждая форма движения имеет свои особенности, и химические явления не сводятся к физическим процессам, а биологические — к химическим и физическим.
Для того чтобы установить свойства вещества, нужно иметь его в чистом виде, но в чистом виде вещества в природе не встречаются. Природные вещества представляют из себя смеси, состоящие иногда из очень большого числа различных веществ. Так, например, природная вода всегда содержит растворенные в ней соли и газы. Иногда очень малое содержание примеси может привести к очень сильному изменению некоторых свойств вещества. Например, содержание в цинке лишь сотых долей железа или меди ускоряет его взаимодействие с соляной кислотой в сотни раз. Когда одно из веществ находится в смеси в преобладающем количестве, вся смесь обычно носит его название.
Вещество может состоять из одинаковых по составу и строению химических частиц – в этом случае его называют чистым, или индивидуальным, веществом. Если же частицы разные, то – смесью. Индивидуальное вещество – химическое вещество,состоящее из химических частиц, одинаковых по составу и строению.
(В настоящее время в химии нет общепринятого всеобъемлющего определения этого понятия)
Это относится как к молекулярным, так и к немолекулярным веществам. Например, молекулярное вещество " вода" состоит из одинаковых по составу и строению молекул воды, а немолекулярное вещество " поваренная соль" состоит из одинаковых по составу и строению кристалликов поваренной соли.
Большинство природных веществ представляет собой смеси. Например, воздух – смесь молекулярных веществ " азота" и " кислорода" с примесями других газов, а горная порода " гранит" – смесь немолекулярных веществ " кварца" , "полевого шпата" и " слюды" также с различными примесями.
Индивидуальные химические вещества часто называют просто веществами.
Химические вещества могут содержать атомы только одного химического элемента или атомы разных элементов. По этому признаку вещества делят на простые и сложные. Простое вещество – индивидуальное вещество,в состав которого входят атомы только одного элемента.
Например, простое вещество " кислород" состоит из двухатомных молекул кислорода, а в состав вещества " кислород" входят только атомы элемента кислорода. Другой пример: простое вещество " железо" состоит из кристаллов железа, а в состав вещества " железо" входят только атомы элемента железа. Исторически сложилось так, что обычно простое вещество имеет то же название, что и элемент, атомы которого входят в состав этого вещества.
Однако некоторые элементы образуют не одно, а несколько простых веществ. Например, элемент кислород образует два простых вещества: " кислород" , состоящий из двухатомных молекул, и " озон" , состоящий из трехатомных молекул. Элемент углерод образует два широко известных немолекулярных простых вещества: алмаз и графит. Такое явление называется аллотропией. Аллотропия – образование одним химическим элементом нескольких простых веществ.
Эти простые вещества называются аллотропными модификациями. Они одинаковы по качественному составу, но отличаются друг от друга строением. Сложное вещество – индивидуальное вещество,в состав которого входят атомы разных элементов
Так, сложное вещество " вода"состоит из молекул воды, которые, в свою очередь, состоят из атомов водорода и кислорода. Следовательно, атомы водорода и атомы кислорода входят в состав воды. Сложное вещество " кварц" состоит из кристаллов кварца, кристаллы кварца состоят из атомов кремния и атомов кислорода, то есть атомы кремния и атомы кислорода входят в состав кварца. Конечно, в состав сложного вещества могут входить атомы и более чем двух элементов.
Сложные вещества иначе называют соединениями.
Каждый из объектов материальной системы (кроме элементарных частиц) сам является системой, то есть состоит из других, более мелких, объектов, связанных между собой. Итак, любая система сама является сложным объектом, а почти все объекты представляют собой системы. Например, важная для химии система – молекула – состоит из атомов, связанных между собой химическими связями (о природе этих связей вы узнаете, изучив главу 7). Другой пример: атом. Он также представляет собой материальную систему, состоящую из атомного ядра и связанных с ним электронов (о природе этих связей вы узнаете, изучив главу 3).
Каждый объект можно более или менее подробно описать или охарактеризовать, то есть перечислить его характеристики.
В химии объектами являются, прежде всего, вещества. Химические вещества бывают самые разнообразные:жидкие и твердые, бесцветные и окрашенные, легкие и тяжелые, активные и инертные и так далее. Одно вещество от другого отличается по целому ряду признаков, которые, как вы знаете, называются характеристиками. Характеристика вещества – особенность, присущая данному веществу.
Существуют самые разнообразные характеристики веществ: агрегатное состояние, цвет, запах, плотность, способность плавиться, температура плавления, способность разлагаться при нагревании, температура разложения, гигроскопичность (способность поглощать влагу), вязкость, способность взаимодействовать с другими веществами и многие другие. Важнейшие из этих характеристик – состав и строение. Именно от состава и строения вещества зависят все его остальные характеристики, в том числе и свойства.
Различают качественный состав и количественный состав вещества.
Чтобы описать качественный состав вещества, перечисляют, атомы каких элементов входят в состав этого вещества.
При описании количественного состава молекулярного вещества указывают атомы каких элементов и в каком количестве образуют молекулу данного вещества.
При описании количественного состава немолекулярного вещества указывают отношение числа атомов каждого из элементов, входящих в состав этого вещества.
Под строением вещества понимают а) последовательность соединения между собой атомов, образующих данное вещество; б) характер связей между ними и в) взаимное расположение атомов в пространстве.
Вещество остается самим собой, то есть химически неизменным, до тех пор, пока сохраняются неизменными состав и строение его молекул (для немолекулярных веществ – пока сохраняется его состав и характер связей между атомами).
Как и для других систем, среди характеристик веществ в особую группу выделяются свойства веществ, то есть их способность изменяться в результате взаимодействия с другими телами или веществами, а также в результате взаимодействия составных частей данного вещества.
Второй случай довольно редкий, поэтому свойства вещества можно определить как способность этого вещества определенным образом изменяться при каком-либо внешнем воздействии. А так как внешние воздействия могут быть самыми разнообразными (нагревание, сжатие, погружение в воду, смешивание с другим веществом и тому подобное) то и изменения они могут вызвать тоже различные. При нагревании твердое вещество может расплавиться, а может и разложиться без плавления, превратившись в другие вещества. Если вещество при нагревании плавится, то мы говорим, что оно обладает способностью плавиться. Это свойство данного вещества (оно проявляется, например, у серебра и отсутствует у целлюлозы). Также и жидкость при нагревании может закипеть, а может и не закипеть, а тоже разложиться. Это – способность кипеть (она проявляется, например, у воды и отсутствует у расплавленного полиэтилена). Погруженное в воду вещество может раствориться в ней, а может и не раствориться, это свойство – способность растворяться в воде. Бумага, поднесенная к огню, на воздухе загорается, а золотая проволока – нет, то есть бумага (вернее, целлюлоза) проявляет способность гореть на воздухе, а золотая проволока не обладает этим свойством. Различных свойств у веществ очень много.
Способность плавиться, способность кипеть, способность деформироваться и тому подобные свойства относятся к физическим свойствам вещества.
Физические свойства вещества – свойства, проявляемые веществом в процессах, при которых вещество остается химически неизменным.
Химические свойства вещества – свойства, проявляемые веществом в процессах, при которых оно превращается в другое или другие вещества.
Катализаторы и биокатализаторы
Катализа́тор — вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции (Химическая энциклопедия). Количество катализатора, в отличие от других реагентов, после реакции не изменяется. Обеспечивая более быстрый путь для реакции, катализатор реагирует с исходным веществом, получившееся промежуточное соединение подвергается превращениям и в конце расщепляется на продукт и катализатор. Затем катализатор снова реагирует с исходным веществом, и этот каталитический цикл многократно (до миллиона раз) повторяется.
Многие реакции протекают очень медленно, если просто смешать реагирующие вещества, но их можно значительно ускорить путем введения некоторых других веществ называемых катализаторами. При реакции они не расходуются. При этом большее число молекул может преодолеть более низкий энергетический барьер, что приводит к увеличению скорости реакции. Он только ускоряет реакцию, которая может происходить и без него, но значительно медленнее.
Очень большое число катализаторов, называемых ферментами, содержится в живых тканях. Наиболее известные ферменты пищеварительной системы — птиалин, содержащийся в слюне, и пепсин, вырабатываемый поджелудочной железой. Оба эти фермента способствуют разрушению больших молекул, например, крахмала и белка, на более простые молекулы, которые могут непосредственно усваиваться клетками организма. Помимо сравнительно небольшого числа ферментов пищеварительной системы, существует большое количество других ферментов, принимающих участие в биохимических реакциях. Специфическое действие катализатора во многих случаях еще не выяснено. Поиск подходящего катализатора для каждой реакции обычно требует большой экспериментальной работы.
Биокатализаторы, то же, что ферменты,
Ферме́нты или энзи́мы (от лат. fermentum, греч. ζύμη, ἔνζυμον — дрожжи, закваска) — обычно белковые молекулы или молекулы РНК (рибозимы) или их комплексы, ускоряющие (катализирующие) химические реакции в живых системах. Реагенты в реакции, катализируемой ферментами, называются субстратами, а получающиеся вещества — продуктами. Ферменты специфичны к субстратам (АТФаза катализирует расщепление только АТФ, а киназа фосфорилазы фосфорилирует только фосфорилазу). Ферментативная активность может регулироваться активаторами и ингибиторами (активаторы — повышают, ингибиторы — понижают). Белковые ферменты синтезируются на рибосомах, а РНК — в ядре.
Термины «фермент» и «энзим» давно используют как синонимы (первый в основном в русской и немецкой научной литературе, второй — в англо- и франкоязычной).
Наука о ферментах называется энзимологией, а не ферментологией (чтобы не смешивать корни слов латинского и греческого языков).
Невозможность классического описания поведения электронов в атоме
Известно, что серьезная проблема в классической физике возникла при попытках описания атомных спектров излучения и поглощения. Эта задача привела к возникновению описания атома, основанного на постулатах квантовой механики. Вначале квантовая механика основывалась на постулатах Бора, а затем в качестве основного постулата было взято волновое уравнение Шредингера.
Из представленного здесь рассмотрения поведения электронов следует, что из-за переворота спина электрона возникают очень большие кратковременные силы, действующие на электрон. При перевороте спина электрон переходит на другую орбиту, излучая или поглощая при этом квант электромагнитного излучения на частоте ω=ε/ћ, где ε - энергия перехода. Однако конкретно орбиты электронов в атомах до сих пор не описаны. Имеются только некоторые идеи как их получить.
Организация электронных состояний атома в электронных оболочках
Электронная оболочка атома — область пространства вероятного местонахождения электронов, характеризующихся одинаковым значением главного квантового числа n и, как следствие, располагающихся на близких энергетических уровнях. Каждая электронная оболочка может иметь определенное максимальное число электронов.
Порядок заполнения электроннных оболочек (орбиталей с одинаковым значением главного квантового числа n) определяется правилом Клечковского, порядок заполнения электронами орбиталей в пределах одного подуровня (орбиталей с одинаковыми значениями главного квантового числа n и орбитального квантового числа l) определяется Правилом Хунда.
Электронные оболочки обозначаются буквами K, L, M, N, O, P, Q или цифрами от 1 до 7. Подуровни оболочек обозначаются буквами s, p, d, f, g, h, i или цифрами от 0 до 6. Электроны внешних оболочек обладают большей энергией, и, по сравнению с электронами внутренних оболочек, находятся дальше от ядра, что делает их более важными в анализе поведения атома в химических реакциях и в роли проводника, так как их связь с ядром слабее и легче разрывается.
Каждая оболочка состоит из одного или нескольких подуровней, каждый из которых состоит из атомных орбиталей. К примеру, первая оболочка (K) состоит из одного подуровня "1s". Вторая оболочка (L) состоит из двух подуровней, 2s и 2p. Третья оболочка - из "3s", "3p" и "3d". Возможные варианты подуровней оболочек приведены в следующей таблице:
Валентная оболочка - самая внешняя оболочка атома. Электроны этой оболочки зачастую неверно называют валентными электронами, т.е. электронами, определяющими поведение атома в химических реакциях. С точки зрения химической активности, наименее активными считаются атомы, в которых валентная оболочка окончательно заполнена (инертные газы). Наибольшей химической активностью обладают атомы, в которых валентная оболочка состоит всего из одного электрона (щелочные металлы), и атомы, в которых одного электрона не хватает для окончательного заполнения оболочки (галогены).
На самом деле всё немного иначе. Поведение атома в химических реакциях определяют электроны, обладающие большей энергией, т.е. те электроны, которые расположены дальше от ядра. Электроны внутренних подуровней оболочек имеют меньшую энергию, чем электроны внешних подуровней. Несмотря на то, что электроны подуровня оболочки 3d могут не принадлежать к т.н. валентной оболочке, они могут иметь энергию большую, чем электроны подуровня оболочки 4s, что делает их валентными электронами.
Дискретность электронных состояний в атоме
ДИСКРЕТНОСТЬ (от лат. discretus - разделенный, прерывистый) изменение состояние атома скачками
Очень важными были опыты Дж. Франка и Г. Герца, показавшие дискретность, т.е. квантование, энергии электрона в атоме.
На основе этих экспериментов была предложена модель строения атома, учитывающая вышеперечисленные открытия. Вот ее положения:
1. Атом состоит из ядра и электронов.
2. Ядро заряжено положительно, а электроны отрицательно.
3. Ядро состоит из протонов и нейтронов.
4. Протон является носителем элементарного положительного заряда, равного по значению (1,6•10-19 Кл), но противоположного по знаку заряду электрона. Нейтрон заряда не имеет. Таким образом, заряд ядра (Z) равен числу протонов.
Z=Np.
5. Число протонов определяет порядковый номер элемента. Общее название протонов и нейтронов — нуклоны.
6. Протоны и нейтроны имеют примерно одинаковые массы (mp=mn=1 а.е.м.). Масса атома определяется суммарным числом протонов и нейтронов, поскольку масса электрона в 2000 раз меньше массы протона. Сумма чисел протонов (Np) и нейтронов (N) определяет массовое число атома (А).
7. Электроны вращаются вокруг ядра. Число электронов равно числу протонов (атом электронейтрален).
Свойства элементарных частиц, образующих атом
Принадлежность атома к какому-либо элементу определяется зарядом его ядра Z, т.е. числом протонов. При этом число нейтронов и, соответственно, массовое число у атомов одного и того же элемента может различаться. Такие атомы называются изотопами.
Изотопами называют атомы с одинаковым зарядом ядра, но имеющие разные массовые числа.
Таким образом, изотопы — это атомы одного элемента, имеющие разную массу.
Каждый изотоп характеризуется двумя величинами: А (проставляется вверху слева от химического знака) и N (проставляется снизу слева от химического знака) и обозначается символом соответствующего элемента. Например: изотоп углерода 126C или словами: «углерод-12» Эта форма записи распространена на элементарные частицы: электронов, нейтрон 10n, протон 11p, нейтрино 00vi. Изотопы известны для всех химических элементов: кислород имеет изотопы с массовыми числами 16, 17, 18: 168О, 178O, 188O. Изотопы аргона: 3618Ar, 3818Ar, 4018Ar; калия: 3919K, 4019K, 4119K.
Атомная масса элемента равна среднему значению из масс всех его природных изотопов с учетом распространенности их.
Например, средняя атомная масса природного лития, содержащего 92,48% 73Li и 7,52% 63Li, равна 6,94 и т.д.
Атомная масса элементов, приводимых в периодической системе Д. И. Менделеева, есть средние массовые числа природных смесей изотопов.
Наряду с термином «изотопы» используется термин «нуклид».
Нуклид -- атом со строго определенным значением массового числа, т.е. фикзированным значением числа протонов и нейтронов в ядре. Радионуклид -- радиоактивнуй нуклид.
Например, нуклид 16О, радионуклид 14С и т.д. Термин «изотопы» следует применять только для стабильных и радиоактивных нуклидов одного элемента.
Ядерные реакции отличаются от химических, в которых атомы реагирующих веществ вступают в новые комбинации, образуя продукты реакции, но ядра атомов остаются неизменными.
В ядерных реакциях происходит перераспределение протонов и нейтронов в ядрах атомов, и образуются новые элементы.
У некоторых элементов атомы неустойчивы и самопроизвольно распадаются с образованием более легких атомов. Ядро расщепляется, и из его протонов и нейтронов образуется два новых ядра, а электроны исходного атома образуют электронные оболочки двух новых атомов. Иногда распад атома состоит в превращении нейтрона в протон или протона в нейтрон. Такое превращение сопровождается образованием новых частиц, которые покидают атом. Атомы могут также самопроизвольно распадаться на два осколка, или ядро атома может испустить протон. Самопроизвольный распад атома называют радиоактивным распадом. Если все изотопы данного химического элемента радиоактивны, то такой элемент называют радиоактивным. Испускание частиц и выделение энергии — это признаки радиоактивности.
Распад радиоактивных веществ сопровождается испусканием излучения, которое получило название a- (альфа),)b- (бета) или g- (гамма) излучения. Каждое из них ионизирует атомы вещества, через которое оно проходит, а a-излучение, кроме того, способно вызывать свечение сульфида цинка. Их проникающая способность различна: например, g-излучение способно пройти слой воздуха в несколько десятков метров, b-излучение — на порядок меньше, а a-излучение — всего несколько сантиметров.
К основным видам радиоактивного распада относятся a-распад, b-распад, спонтанное деление атомных ядер и протонный распад. Часто эти виды радиоактивного распада сопровождаются испусканием g-лучей, т.е. жесткого (с малой длиной волы) электромагнитного излучения.
При a-распаде ядро атома испускает два протона и два нейтрона, связанные в ядро атома гелия 42Не; это приводит к уменьшению заряда исходного радиоактивного ядра на 2, а его массового числа на 4. Таким образом, в результате a-распада образуется атом элемента, смещенного на два места от исходного радиоактивного элемента к началу периодической системы.
Возможность b-распада связана с тем, что по современным представлениям протон и нейтрон представляют собой два состояния одной и той же элементарной частицы — нуклона (от лат. nucleus — ядро). При известных условиях (например, когда избыток нейтронов в ядре приводит к его неустойчивости) нейтрон может превращаться в протон, одновременно «рождая» электрон:
нейтрон ® протон + электрон или n ®р+ е-
Таким образом, при b-распаде один из нейтронов, входящих в состав ядра, превращается в протон; возникающий при этом электрон вылетает из ядра, положительный заряд которого на единицу возрастает.
Возможно также превращение протона в нейтрон: протон ® нейтрон + позитрон или p® n + n+, где n+ — позитрон — элементарная частица с массой, равной массе электрона, но несущая положительный электрический заряд; по абсолютной величине заряды электрона и позитрона одинаковы. Процесс превращения протона в нейтрон с образованием позитрона может происходить в тех соединениях, когда неустойчивость ядра вызвана избыточным содержанием в нем протонов. При этом один из протонов, входящих в состав ядра, превращается в нейтрон, возникающий позитрон вылетает за пределы ядра, а заряд ядра на единицу уменьшается. Такой вид радиоактивного распада называется позитронным b-распадом (или b+-распадом) в отличие от ранее рассмотренного электронного b-распада (b--распада). Этот вид радиоактивного распада наблюдается у некоторых искусственно полученных радиоактивных изотопов.
Изменение заряда ядра при b-распаде приводит к тому, что в результате b-распада образуется атом элемента, смещенного на одно место от исходного радиоактивного элемента к концу периодической системы (в случае b--распада) или к ее началу (в случае b+-распада).
К уменьшению заряда ядра на единицу приводит не только b+-распад, но и электронный, захват, при котором один из электронов атомной электронной оболочки захватывается ядром; взаимодействие этого электрона с одним из содержащихся в ядре протонов приводит к образованию нейтрона:
Электрон чаще всего захватывается из ближайшего к ядру К-слоя (.К-захват), реже из L или М-слоев.
Спонтанным делением называется самопроизвольный распад ядер тяжелых элементов на два (иногда на три или четыре) ядра элементов середины периодической системы. Варианты такого деления очень разнообразны, так что общих правил смещения по периодической системе не существует; чаще всего происходит распад исходного ядра на тяжелый и легкий осколки, несущие, соответственно, около 60 и 40% заряда и массы исходного ядра. Относительное содержание нейтронов в ядрах тяжелых элементов выше, чем для ядер устойчивых изотопов середины периодической системы, поэтому при спонтанном делении распадающееся ядро испускает 2-4 нейтрона; образующиеся ядра все еще содержат избыток нейтронов, оказываются неустойчивыми и поэтому претерпевают ряд b--распадов.
Протонный распад представляет собой самопроизвольный распад ядер с дефицитом нейтронов, сопровождающийся испусканием одного или одновременно двух протонов. Образующееся ядро имеет заряд и массовое число меньше исходного на единицу в случае испускания одного протона и двух единиц при испускании двух протонов.
Элементы, расположенные в конце периодической системы (после висмута), не имеют стабильных изотопов. Подвергаясь радиоактивному распаду, они превращаются в другие элементы. Если вновь образовавшийся элемент радиоактивен, он тоже распадается, превращаясь в третий элемент, и так далее до тех пор, пока не получаются атомы устойчивого изотопа.
Ряд элементов, образующихся подобным образом один из другого, называют радиоактивным рядом.
Например, ряд урана:
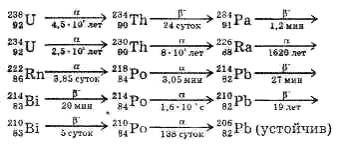
ИЗОТОПЫ — разновидности одного и того же химического элемента, близкие по своим физико-химическим свойствам, но имеющие разную атомную массу. Название "изотопы" было предложено в 1912 английским радиохимиком Фредериком Содди, который образовал его из двух греческих слов: isos — одинаковый и topos — место. Изотопы занимают одно и то же место в клетке периодической системы элементов Менделеева.
Атом любого химического элемента состоит из положительно заряженного ядра и окружающего его облака отрицательно заряженных электронов (см.также АТОМА ЯДРО). Положение химического элемента в периодической системе Менделеева (его порядковый номер) определяется зарядом ядра его атомов. Изотопами называются поэтому разновидности одного и того же химического элемента, атомы которых имеют одинаковый заряд ядра (и, следовательно, практически одинаковые электронные оболочки), но отличаются значениями массы ядра. По образному выражению Ф.Содди, атомы изотопов одинаковы "снаружи", но различны "внутри".
В 1932 был открыт нейтрон — частица, не имеющая заряда, с массой, близкой к массе ядра атома водорода — протона, и создана протонно-нейтронная модель ядра. В результате в науке установилось окончательное современное определение понятия изотопов: изотопы — это вещества, ядра атомов которых состоят из одинакового числа протонов и отличаются лишь числом нейтронов в ядре. Каждый изотоп принято обозначать набором символов , где X — символ химического элемента, Z — заряд ядра атома (число протонов), А — массовое число изотопа (общее число нуклонов — протонов и нейтронов в ядре, A = Z + N). Поскольку заряд ядра оказывается однозначно связанным с символом химического элемента, часто для сокращения используется просто обозначение AX.
Модель атома сама по себе нейтральна.
ИОНИЗАЦИЯ -образование положит. и отрицат. ионов и свободных эл-нов из электрически нейтральных атомов и молекул.
ВОЗБУЖДЕНИЕ АТОМА И МОЛЕКУЛЫ - квантовый переход атома или молекулы с более низкого (напр., основного) уровня энергии на более высокий при поглощении ими фотонов (фотовозбуждение) или при столкновениях с электронами и др. частицами (возбуждение ударом).
Согласно принципам квантовой механики, атомы и молекулы устойчивы лишь в нек-рых стационарных состояниях, к-рым отвечают определ. значения энергии. Состояние с наинизшей энергией наз. основным, остальные -возбужденными. Изменение энергии атома при переходе из одного стационарного состояния в другое связано с изменением строения его электронной оболочки
Характер любой системы, как известно, зависит не только от ее строения и состава ее элементов, но и от их взаимодействия. Именно такое взаимодействие определяет специфические, целостные свойства самой системы. Поэтому при исследовании разнообразных веществ и их реакционной способности ученым приходится заниматься и изучением их структур. Соответственно уровню достигнутых знаний менялись и представления о химической структуре веществ.
В данном реферате доказаны следующие задачи
- рассмотрены методы и концепции познания в химии;
- дано понятие состава вещества и химических систем;
- проанализировано изучение структуры веществ в рамках химической системы.
Рассмотрев таблицу Менделеева, выяснили, что Периодическая система является графическим выражением периодического закона.
1. Грушевская Т.Г. , Садохин П.П. Концепции современного естествознания: Учеб. Пособие: Высшая школа., М.: 1998
2. Линдер Г. Картины современной физики. Пер. с нем. Ю.Г.Рудого. Предисл. Н.В.Мицкевича. - М.: Мир, 1977. - 272 с. с ил.
3. Мигдал А.Б. Квантовая физика для больших и маленьких. - М.: Наука, 1989. - 144 с.
4. Эйнштейн А., Инфельд Л. Эволюция физики. - М.: Наука, 1965. - 328 с. с ил.