Рефераты по авиации и космонавтике
Рефераты по административному праву
Рефераты по безопасности жизнедеятельности
Рефераты по арбитражному процессу
Рефераты по архитектуре
Рефераты по астрономии
Рефераты по банковскому делу
Рефераты по сексологии
Рефераты по информатике программированию
Рефераты по биологии
Рефераты по экономике
Рефераты по москвоведению
Рефераты по экологии
Краткое содержание произведений
Рефераты по физкультуре и спорту
Топики по английскому языку
Рефераты по математике
Рефераты по музыке
Остальные рефераты
Рефераты по биржевому делу
Рефераты по ботанике и сельскому хозяйству
Рефераты по бухгалтерскому учету и аудиту
Рефераты по валютным отношениям
Рефераты по ветеринарии
Рефераты для военной кафедры
Рефераты по географии
Рефераты по геодезии
Рефераты по геологии
Рефераты по геополитике
Рефераты по государству и праву
Рефераты по гражданскому праву и процессу
Рефераты по кредитованию
Рефераты по естествознанию
Рефераты по истории техники
Рефераты по журналистике
Рефераты по зоологии
Рефераты по инвестициям
Рефераты по информатике
Исторические личности
Рефераты по кибернетике
Рефераты по коммуникации и связи
Рефераты по косметологии
Рефераты по криминалистике
Рефераты по криминологии
Рефераты по науке и технике
Рефераты по кулинарии
Рефераты по культурологии
Рефераты по авиации и космонавтике
Рефераты по административному праву
Рефераты по безопасности жизнедеятельности
Рефераты по арбитражному процессу
Рефераты по архитектуре
Рефераты по астрономии
Рефераты по банковскому делу
Рефераты по сексологии
Рефераты по информатике программированию
Рефераты по биологии
Рефераты по экономике
Рефераты по москвоведению
Рефераты по экологии
Краткое содержание произведений
Рефераты по физкультуре и спорту
Топики по английскому языку
Рефераты по математике
Рефераты по музыке
Остальные рефераты
Рефераты по биржевому делу
Рефераты по ботанике и сельскому хозяйству
Рефераты по бухгалтерскому учету и аудиту
Рефераты по валютным отношениям
Рефераты по ветеринарии
Рефераты для военной кафедры
Рефераты по географии
Рефераты по геодезии
Рефераты по геологии
Рефераты по геополитике
Рефераты по государству и праву
Рефераты по гражданскому праву и процессу
Рефераты по кредитованию
Рефераты по естествознанию
Рефераты по истории техники
Рефераты по журналистике
Рефераты по зоологии
Рефераты по инвестициям
Рефераты по информатике
Исторические личности
Рефераты по кибернетике
Рефераты по коммуникации и связи
Рефераты по косметологии
Рефераты по криминалистике
Рефераты по криминологии
Рефераты по науке и технике
Рефераты по кулинарии
Рефераты по культурологии
Курсовая работа: Генетически модифицированные организмы в колбасных изделиях
Курсовая работа: Генетически модифицированные организмы в колбасных изделиях
КУРСОВАЯ РАБОТА
Генетически модифицированные организмы в колбасных изделиях
Содержание
I. Обзор литературы
Краткая история возникновения генетически модифицированных организмов
Положительные и отрицательные стороны ГМО
Законодательство в сфере ГМО
II. Материалы, методы исследования и способы получения трансгенных животных и растений
Получение трансгенных животных
Способы получения ГМ микроорганизмов
Получение трансгенных растений
Обнаружение ГМ- продуктов с помощью СIM- монолитных колонок для выделения ДНК
Способы выявления ГМ- ингридиентов в колбасе
Список использованной литературы
I. Обзор литературы
Что такое ГМО (трансгены)?
Генетически модифицированные организмы (трансгены, ГМО) – это организмы (бактерии, растения, животные), в которые были искусственно, невозможным в природе способом, внедрены гены других организмов.
ГМО объединяют три группы организмов – генетически модифицированные микроорганизмы (ГММ), животные (ГМЖ) и растения (ГМР).
Технологию, позволяющую создать ГМО – генную инженерию — часто называют современной биотехнологией. Эта технология имеет большие перспективы в самых разных сферах человеческой жизни. Однако при этом, как и любая другая, она должна применяться с осторожностью и целью ее внедрения не должно являться лишь получение прибыли.
Генная инженерия уже многие годы с успехом применяется в медицине. Например, при помощи трансгенной бактерии производится человеческий инсулин, который уже спас сотни тысяч человеческих жизней. В таких случаях ГМО находятся в закрытом пространстве лаборатории и никак не взаимодействуют с окружающей средой, а конечным продуктом является не сам ГМО (например, бактерия с измененным генетическим кодом), а его производное – то есть, как в данном случае, инсулин. Относительно подобного использования ГМО у большинства общества опасений нет.
Но все же наиболее массово эта технология применяется в сельском хозяйстве. И в этом случае с ГМО (а не с его производными) сталкиваются в обычной жизни каждый человек и фактически ежедневно. Кроме того, эти новые организмы попадают в окружающую среду. Например, создан картофель, имеющий ген земляной бактерии Bt, который придает ему устойчивость к колорадскому жуку. Сельскохозяйственные ГМ-культуры выращиваются в отрытом грунте и взаимодействуют с окружающей средой, являются продуктом, который идет в пищу человеку, животному или применятся в качестве сырья для производства продуктов питания.
Современные биотехнологии (создание ГМО) в зависимости от назначения подразделяются на четыре типа:
• Красные биотехнологии – использование ГМО в качестве фабрики для производства лекарственных препаратов.
• Зеленые биотехнологии – использование ГМ-растений в сельском хозяйстве и лесоводстве.
• Белые биотехнологии – использование ГМО в различных отраслях промышленности.
Существует также термин «голубые биотехнологии», он, как правило, применяется к модификациям в водных экосистемах.
Генная инженерия, как и любое научное направление, может принести людям пользу. Экологи считают, что ученые, работающие в данной сфере, должны обладать высокой профессиональной этикой, а общество должно знать, что, как и зачем делается в лабораториях этих ученых. Инициаторами и единственной заинтересованной стороной практического применения генной инженерии не должны быть коммерческие корпорации. Это приводит к использованию генной инженерии лишь в целях получения прибыли, к монополизации рынка продовольствия и не гарантирует безопасное и полезное для общества применение данной технологии.
Краткая история возникновения генетически модифицированных организмов
Истоки развития генной инженерии растений лежат в 1977 году, когда и произошло открытие, позволившее использовать почвенный микроорганизм Agrobacterium tumefaciens в качестве орудия введения чужих генов в другие растения.
В 1987 году были произведены первые полевые испытания генетически модифицированных сельскохозяйственных растений. Как итог — помидор, устойчивый к вирусным инфекциям. В 1992 г. в Китае начали выращивать табак, который «не боялся» вредных насекомых. Но начало массовому производству модифицированных продуктов положили в 1994 г., когда в США появились помидоры сорта FlavrSavr , которые не портились при перевозке. Это помидоры с отложенным созреванием, которые хранятся до полугода при температуре 14-16 градусов. Дозревание происходит при помещении его в комнатную температуру.
1994 г. считается официальным годом рождения ГМ-продуктов. В 1995 году американская компания-гигант Monsanto запустила на рынок ГМ-сою RoundupReady. В ДНК растения был внедрен чужеродный ген для повышения способности культуры противостоять сорнякам. В результате сейчас существует картофель, который содержит гены земляной бактерии, убивающей колорадского жука; стойкая к засухам пшеница, в которую вживили ген скорпиона; помидоры с генами морской камбалы; соя и клубника с генами бактерий.
Список растений, выращивающихся с применением методов генной инженерии очень большой. В него входят: яблоня, слива, виноград, капуста, баклажаны, огурец, пшеница, соя, рис, рожь и множество других сельскохозяйственных растений.
Положительные и отрицательные стороны ГМО
Для объективной оценки пользы или вреда, который ГМО приносят человеку, мы решили определить положительные и отрицательные стороны их применения человеком.
ГМ-источники применяются в медицине для создания вакцин с повышенной эффективностью действия. Уже создана универсальная вакцина, защищающая от аллергических реакций, вызванных вдыханием пыльцы различных растений. Ее активным ингредиентом служит ГМ-белок. Этот мутантный протеин десятикратно снижает интенсивность болезненных реакций на растительную пыльцу и одновременно мобилизует иммунную систему на защиту организма от последствий аллергенной атаки. Предварительные испытания вакцины показали, что она не создает угрозы анафилактического шока и практически одинаково помогает всем страдающим от пыльцевой аллергии.
С помощью ГМ-продуктов представляется возможным обеспечить продовольствием голодающие страны. Кроме того, у выращиваемых трансгенных культур значительно увеличивается урожайность и срок хранения плодов, они становятся более устойчивыми к вредителям и неблагоприятным условиям. Например, картофель, модифицированный геном эндотоксина, стал устойчивым к основному вредителю – колорадскому жуку.
Некоторые ученные утверждают, что генетически модифицированные растения намного более экологически безопасны, чем их не модифицированные аналоги.
Тогда возникает вопрос: почему люди боятся ГМО?
Основной источник опасности – несовершенство технологий получения трансгенных организмов. Несмотря на то, что генная инженерия – это высокая современная и достаточно развитая наука, при создании ГМО ученные все еще действуют вслепую. Вставляя генный фрагмент, они точно не знают, в какой именно участок генома он попадет, и как это отразится на его работе. Трансформированная клетка приобретает совершенно новые, нехарактерные для нее свойства.
Научно зафиксированы отдельные факты исчезновения в местах выращивания ГМ-растений целых групп насекомых, возникновение новых мутантных форм сорных растений и насекомых, биологического и химического загрязнения почв и постепенной потери биоразнообразия, особенно в центрах возникновения культурных растений. Это весьма актуальная проблема для России поскольку наша страна владеет богатым разнообразием генетических ресурсов сельскохозяйственных растений и животных, которые необходимо сберечь для будущих поколений.
Был проведен ряд экспериментов на крысах: у потреблявших ГМ-продукты животных происходило нарушение клеточной структуры желудка и печени, изменялась формула крови, уменьшался вес животных в эксперименте и вес головного мозга. Эти опыты подтвердили предположения ученых о негативном влиянии ГМ-еды на организм: на иммунную систему, желудочно-кишечный тракт, печень и мозг.
Манипуляции с генами могут привести:
-к непредсказуемому увеличению содержания или появлению в пище абсолютно новых токсинов;
-спровоцировать онкологические заболевания;
-вызвать пищевые аллергии.
-к разрушению природных экосистем и нарушению экологического равновесия в природе при культивировании трансгенных растений.
В связи с этим подробно рассмотрим историю получения и безопасность при употреблении в пищу картофеля, который модифицирован геном эндотоксина (Bt), взятого из бактерии Bacillus thuringiensis, благодаря чему картофель стал устойчивым к основному вредителю - колорадскому жуку. Bt сам по себе не ядовит для млекопитающих. Но геном Bacillus несет ряд генов, кодирующих другие токсины, которые потенциально опасны для человека и способны вызывать диарею, разрушать почки и печень. Были проведены эксперименты на мышах, которым давали в пищу клубни обычного картофеля, картофеля, выращенного при опрыскивании Bt, и модифицированного сорта, несущего ген Bt. Диета из картофеля, опрысканного Bt, вызвала сильные изменения в морфологии клеток печени и некоторые другие отклонения.
В России нет лабораторий, способных в необходимом объеме проводить количественные оценки содержания генетически модифицированного белка в пищевых продуктах, нет утвержденных методик, нет средств для осуществления постоянного мониторинга.
“Будет разрушен семенной фонд России, а аграрное производство окажется в полной зависимости от транснациональных корпораций. Распространение ГМ-сортов приведет к потере Россией статуса страны-производителя экологически чистых продуктов питания» - Владимир Кузнецов, председатель научного совета Российской академии наук.
Законодательство в сфере ГМО
На сегодня в мире нет точных данных как о безопасности продуктов содержащих ГМО, так и о вреде их употребления, поскольку длительность наблюдений за последствиями употребления генетически модифицированных продуктов человеком мизерна – массовое производство ГМО началось совсем недавно – в 1994 году. Тем не менее, все больше ученых говорят о существенных рисках употребления ГМ -продуктов.
Поэтому ответственность за последствия решений, касающихся регулирования производства и сбыта генетически измененных продуктов, лежит исключительно на правительствах конкретных стран. К этому вопросу в мире подходят по-разному. Но, независимо от географии, наблюдается интересная закономерность: чем меньше в стране производителей ГМ-продукции, тем лучше защищены права потребителей в данном вопросе.
Две трети всех ГМ- культур в мире выращиваются в США, поэтому не удивительно, что в этой стране самые либеральные законы в отношении ГМО. Трансгены в США признаны безопасными, приравнены к обычным продуктам, а маркировка продуктов, содержащих ГМО – необязательна. Подобная ситуация и в Канаде – третьей по объемам производства ГМ-продуктов в мире.
В Японии продукты, содержащие ГМО, подлежат обязательной маркировке. В Китае ГМО-продукты производятся нелегально, и осуществляется их сбыт в другие страны. А вот страны Африки последние 5 лет не допускают на свою территорию ввоза продуктов с ГМ-компонентами.
В странах Евросоюза, к которому мы так стремимся, запрещено производство и ввоз на территорию детского питания, содержащего ГМО, и продажа продуктов с генами, устойчивыми к антибиотикам. В 2004 году был снят мораторий на выращивание ГМ- культур, но в то же время разрешение на выращивание было выдано только на один сорт трансгенных растений. При этом у каждой страны ЕС сегодня осталось право вводить запрет на тот или иной вид трансгена. В некоторых странах ЕС действует мораторий на ввоз генетически модифицированной продукции. Любой продукт, содержащий ГМО, прежде чем попасть на рынок Евросоюза, должен пройти единый для всего ЕС порядок допуска. Он состоит, по существу, из двух ступеней: научная оценка безопасности Европейским ведомством по безопасности продуктов питания (EFSA) и его независимыми экспертными органами.
Если продукт содержит ГМ ДНК или белок, об этом граждан ЕС должно информировать специальное обозначение на этикетке. Надписи «этот продукт содержит ГМО» или «ГМ-продукт такой-то» должны быть как на этикетке продукции, продающейся в упаковке, так и для неупакованной продукции в непосредственной близости к ней на витрине магазина. Правила предписывают указывать сведения о наличии трансгенов даже в ресторанных меню.
Продукт не маркируется только в том случае, если содержание в нем ГМО не более 0,9% и соответствующий производитель может объяснить, что речь идет о случайных, технически неизбежных примесях ГМО.
В России выращивать ГМ-растения в промышленных масштабах запрещено, но некоторые импортные ГМО прошли государственную регистрацию в РФ и официально разрешены для употребления – это несколько линий сои, кукурузы, картофеля, линия риса и линия сахарной свеклы. Все остальные ГМО, существующие в мире (около 100 линий), в России запрещены. Разрешенные в России ГМО могут применяться в любом продукте без ограничений. Но если производитель добавляет в продукт ГМ-компоненты, он должен указать это на упаковке.
II. Материалы, методы исследования и способы получения трансгенных животных и растений.
Получение трансгенных животных
Трансгенные животные - экспериментально полученные животные, содержащие во всех клетках своего организма дополнительную интегрированную
с хромосомами и экспрессирующуюся чужеродную ДНК (трансген), которая передаётся по наследству по законам Менделя.
Получение трансгенных животных осуществляется с помощью переноса клонированных генов (ДНК) в ядра оплодотворенных яйцеклеток (зигот) или эмбриональных стволовых (плюрипотентных) клеток. Затем в репродуктивные органы реципиентной самки пересаживают модифицированные зиготы или яйцеклетки, у которых собственное ядро заменено на модифицированное ядро эмбриональных стволовых клеток, либо бластоцисты (эмбрионы), содержащие чужеродную ДНК эмбриональных стволовых клеток. Имеются отдельные сообщения об использовании спермиев для создания трансгенных животных, однако этот приём пока не получил широкого распространения.
В настоящее время для создания трансгенных животных, кроме микроинъекций, используются другие экспериментальные приемы: инфицирование клеток рекомбинантными вирусами, электропорация, «обстрел» клеток металлическими частицами с нанесёнными на их поверхности рекомбинантными ДНК.
Все имеющиеся методы переноса генов пока ещё не очень эффективны. Для получения одного трансгенного животного в среднем необходимы микроинъекции ДНК в 40 зигот мышей, 90 зигот козы, 100 зигот свиньи, 110 зигот овцы и в 1600 зигот коровы. Механизмы интеграции экзогенной ДНК или формирования автономных репликонов (единиц репликации, отличных от хромосом) при трансгенезе не известны. Встраивание трансгенов у каждого вновь получаемого трансгенного животного происходит в случайные участки хромосом, причём может происходить встраивание как единичной копии трансгена, так и множества копий, располагающихся тандемно в единичном локусе одной из хромосом. Гомология между сайтом (местом) интеграции трансгена и самим трансгеном отсутствует. При использовании для трансгеноза эмбриональных стволовых клеток возможна предварительная селекция, что позволяет получать трансгенных животных с трансгеном, интегрированным в результате гомологичной рекомбинации с определённым участком генома хозяйского организма. С помощью этого подхода осуществляют, в частности, целенаправленное прекращение экспрессии определённого гена (это называют «нокаутом гена»).
Способы получения ГМ микроорганизмов
Способность организмов синтезировать те или иные биомолекулы, в первую очередь белки, закодирована в их геноме. Поэтому достаточно «добавить» нужный ген, взятый из другого организма, в бактерию, которая способна расти в простых условиях и чрезвычайно быстро размножаться. Но попытки провести перенос в бактерии непосредственно геномной ДНК привели к противоречивым результатам.
Только в 70-е годы были получены воспроизводимые результаты с применением так называемой векторной трансформации. В основе этого подхода лежит использование векторных молекул – ДНК, способных переносить содержащиеся в них гены в клетку, где эти молекулы реплицируются автономно или после интеграции с геномом. Решающую роль в этих экспериментах сыграли также методы получения индивидуальных генов, наработка их в необходимом количестве путем клонирования, то есть практически неограниченного размножения в бактериальных клетках.
В основе всех достижений генетической инженерии лежит одна из особенностей строения генома бактерий – наличие у них небольших, отличных от хромосомы, кольцевых молекул ДНК, называемых плазмидами.
Плазмиды широко распространены в природе и встречаются у подавляющего числа прокариотических организмов, а также у низших эукариот –дрожжей. Важным свойством плазмид является их способность реплицироваться (размножаться) вместе с ДНК клетки хозяина, и поэтому в последнее время их считают внутриклеточными паразитами или симбионтами. Клетки хозяина не нуждаются в плазмидах для выживания в обычных условиях, но часто плазмиды придают им ряд особых свойств. Плазмиды придают бактериям способность к половому размножению (F-фактор), устойчивость к антибиотикам и дезинфицирующим средствам (R-фактор), возможности усвоения некоторых сложных органических веществ, например, углеводородов.
Основная масса исследований, которые привели к развитию генной инженерии, проводилась на классическом объекте микробиологов – кишечной палочке Escherichia coli. С помощью специальных ферментов – эндонуклеаз рестрикции, или рестриктаз, плазмида, несущая какой-нибудь маркерный ген, например, ген устойчивости к определенному антибиотику, разрезается в строго определенном месте с образованием с каждой стороны нескольких (от одного до пяти) неспаренных оснований – «липких концов». С помощью таких же рестриктаз получается фрагмент генома организма-донора, несущий нужный ген, например, ген человеческого инсулина. В последнее время донорную ДНК чаще получают путем «пришивания» «липких концов» к молекуле ДНК, полученной путем обратной транскрипции с матричной РНК нужного гена (кДНК). Главную роль здесь играет фермент обратная транскриптаза, или ревертаза, впервые открытая у ретровирусов (таких как ВИЧ и некоторые возбудители злокачественных новообразований – онковирусов). Далее за счет комплиментарного взаимодействия неспаренных оснований «липких концов» происходит включение нужного гена в плазмиду, при этом образуется новая рекомбинантная (гибридная) ДНК. Завершает процесс фермент ДНК-лигаза, которая ковалентно зашивает разрывы в цепях ДНК.
Следующий этап – перенос рекомбинантной плазмиды в бактерию.
Такой процесс – включение чужеродной ДНК в бактериальную клетку носит название трансформации, а молекула ДНК – вектор. Это явление иногда встречается в природе, что говорит о том, что трансформация – это естественный биологический процесс. В естественных условиях трансформация встречается у таких бактерий, как возбудитель пневмонии.
Другой способ построения векторных молекул использует бактериофаги – особую группу вирусов, заражающих исключительно бактерии. Наиболее широкое применение получил бактериофаг. Средняя часть генома этого вируса не несет в себе важных функций и может быть заменена на чужеродный фрагмент ДНК. В настоящее время существует очень много векторов, сконструированных на основе различных плазмид и бактериофагов.
Значительно сложнее подвергнуть генетической модификации эукариотические микроорганизмы, к которым относятся грибы, протисты, растения и животные. Как и у бактерий, у них имеются плазмиды, но использование их в качестве векторов часто оказывается не очень эффективно. Поэтому для того, чтобы возник стабильный трансформант, необходимы два последовательных события: проникновение рекомбинантной ДНК в клетку и ее интеграция в хромосомную ДНК. Такой метод называется интегративной трансформацией. В дальнейшем генно-инженерное конструирование у дрожжей пошло по пути создания кольцевых плазмид с центромерами, особыми участками ДНК, обеспечивающими связь с белками веретена деления и, следовательно, равномерное распределение таких плазмид между двумя клетками во время митоза. Развитие этого подхода привело к созданию целых искусственных мини-хромосом, содержащих, помимо центромерного участка, теломеры на концах, загнутые в виде шпильки, и репликаторы – участки начала репликации ДНК. Подобные минихромосомы могут включать сразу несколько полезных генов, что обеспечивает производство нужной биотехнологической продукции.
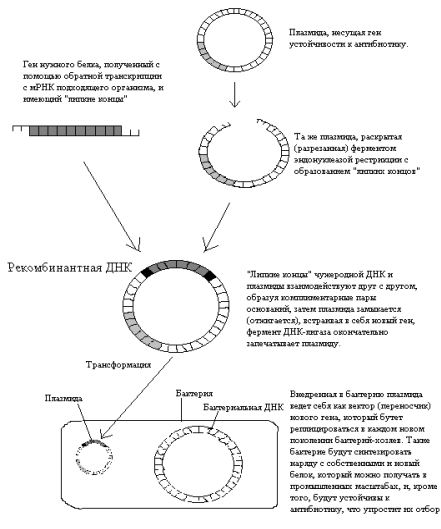
Рис. 1. Упрощенная схема получения
генетически модифицированного микроорганизма
Получение трансгенных растений
Вся работа с трансгенными растениями направлена на коренное изменение методов традиционной селекции – желаемые признаки получаются благодаря введению нужных генов непосредственно в растение вместо длительной работы по скрещиванию различных линий. Сложность такого подхода заключена в том, что в отличие от бактерий и дрожжей, растения, как и животные, являются многоклеточными организмами. Для получения продукта нужный ген должен находиться в каждой клетке организма, что достаточно сложно осуществить. В этом плане растения имеют одно важное преимущество перед животными: возможна их полная регенерация in vitro из недифференцированных соматических тканей с получением нормальных, способных давать семена, растений. Это свойство, называемое тотипотентностью, дает уникальную возможность получить из единичных клеток, генотип которых можно изменить аналогично микроорганизмам, целое растение с новыми признаками. Задача осталась за поиском подходящего вектора для переноса нужного гена в выделенные камбиальные клетки.
Исследователям помогла сама природа. Еще древним грекам было известно явление, называемое корончатыми галлами. В пораженных растениях клетки корончатых галлов приобретают способность неограниченно размножаться, оставаясь недифференцированными. Такие клетки по своим свойствам очень похожи на раковые клетки животных. Но только в XX веке ученым удалось установить и изучить причину возникновения такого явления. Виновницей оказалась одна из почвенных бактерий –Agrobacterium tumefaciens. Такая бактерия, как и многие другие, содержит плазмиды. Одна из них, названная Ti-плазмида (от английского сокращения «опухоль индуцирующая»), и оказалась опухолеродным агентом для клеток зараженного растения.
Ti-плазмида состоит из нескольких функционально различных участков ДНК. Наиболее важную роль играет участок Т-ДНК, который переносится в клетку зараженного растения и встраивается в ее хромосому. Там находятся гены синтеза фитогормонов и опинов. Фитогормоны ауксин и цитикинин подавляют дифференцировку опухолевых растительных клеток и переводят их в состояние деления, а опины используются бактерией как источник углерода, азота и энергии. Другими участками ДНК в Ti-плазмиде являются tra-область, где локализованы гены, контролирующие коньюгацию бактерий, и ori-область, продукты которой обеспечивают размножение плазмиды в бактериальной клетке. Еще один важный локус ДНК называется vir-область. Там содержатся гены, ответственные за перенос Т-ДНК в растительную клетку и встраивание ее в хромосому.
При заражении какого-нибудь двудольного растения Агробактерией происходят следующие процессы: Агробактерии, в изобилии находящиеся в почве, вступают в контакт со стеблем растения, чаще всего в прикорневой области. Вероятность заражения и опухолевой трансформации значительно возрастает, если у растения имеются ранки или повреждения наружного слоя клеток. Бактерии прорастают в ткани растения, живут и размножаются в межклеточном пространстве, не проникая в клетки. Далее происходит процесс трансформации, который можно разделить на несколько этапов: прикрепление бактерии к стенке растительной клетки, проникновение Т-ДНК внутрь клетки, интеграция Т-ДНК в геном растения и экспрессия плазмидных генов. Переноса Т-ДНК не происходит, если растение-хозяин оказывается больным или нежизнеспособным. Если же хозяин окажется здоровым организмом, перенос Т-ДНК происходит примерно за 30 минут. После встраивания в хромосому Т-ДНК становится частью генома растения, и ее гены активно транскрибируются. Клетка приобретает свойства раковой, и происходит рост опухоли – корончатого галла. Бактерии используют трансформированные клетки как фабрику по производству опинов – источника азота, углерода и энергии.
Таким образом, Агробактерии научились генно-инженерным методам задолго до человека. Ti-плазмида оказалась идеальным природным вектором для введения чужеродных генов в клетки растения. Необходимо также отметить следующие достоинства использования методов на основе применения Ti-плазмиды. Во-первых, круг растений – хозяев Агробактерии чрезвычайно широк, включая практически все двудольные растения. В последнее время ученые смогли добиться заражения и многих однодольных, главным образом злаков. Во-вторых, встроенная в геном растения Т-ДНК наследуется как простой доминантный признак по законам Менделя, а чужеродные гены имеют собственные регуляторные области. Для промышленного применения Ti-плазмиду необходимо лишь «немного» усовершенствовать. В целом векторная система на основе Ti-плазмиды должна содержать следующие участки:
1) комплекс генов vir-области, необходимой для переноса и интеграции рекомбинантной ДНК в хромосому растения;
2) систему для узнавания чужеродных генов полимеразами растения –
такой промотор есть в Т-ДНК;
3) маркер, необходимый для селекции трансформированных клеток;
4) уникальные сайты рестрикции, необходимые для введения в конструкцию нужных генов.
Также необходимым условием является отсутствие генов, приводящих к образованию опухоли.
Чаще всего для создания такой генно-инженерной конструкции используют следующий подход. Сегмент Т-ДНК вырезают из Ti-плазмиды с помощью рестриктаз и встраивают в стандартную плазмиду-вектор бактерии Escherichia coli. Рекомбинантная плазмида размножается, и в участок Т-ДНК вставляют нужный ген так же, как и в обычную плазмиду, с использованием рестриктаз. Такой молекулярный гибрид вводят в Agrobacterium tumefaciens, содержащий неизмененную Ti-плазмиду. Благодаря процессу рекомбинации происходит обмен гомологичными участками ДНК рекомбинантной и Ti-плазмид. В результате получится рекомбинантная Ti-плазмида, несущая нужный ген. Последним этапом будет заражение единичных растительных клеток такой Агробактерией и выращивание целого растения, все клетки которого будут экспрессировать нужный ген.
Иногда оказывается проще использовать сразу две рекомбинантные плазмиды. Одна из них содержит только vir-область и является плазмидой-помощницей. Вторая плазмида должна содержать Т-ДНК со встроенным нужным геном. Плазмида-помощница способна переносить в растительную хромосому не только свою Т-ДНК, которой у нее и нет, но и соседнюю. Для облегчения отбора полученных ГМ-растений, рекомбинантная Ti-плазмида несет специальный маркерный ген. В отличие от микроорганизмов, где в качестве маркера используется устойчивость к антибиотикам, в растениях используют особые белки, обладающие способностью светиться в ультрафиолетовом свете. Наиболее часто используют гены люциферазы светлячков и ген GFP медузы (по-английски, «зеленый светящийся белок»).
Помимо технологии, основанной на использовании Ti-плазмиды, в последнее время применяются и другие способы переноса рекомбинантной ДНК в растения. Современный арсенал методов трансформации очень обширен и включает такие подходы, как электропорация клеток (пропускание электрического разряда через смесь опытных клеток и рекомбинантных плазмид, при этом в мембранах клеток возникают бреши, и ДНК проникает в клетку и встраивается в геном), встряхивание смеси клеток, ДНК и микроигл (которые прокалывают мембраны аналогично электрическом току),опосредованная вирусами инфекция, микроинъекции ДНК в клетки. Промышленное применение нашла следующая технология: с помощью специального прибора «Shotgan» осуществляется обстрел растительных тканей мельчайшими пульками из золота или вольфрама, одетыми в молекулы ДНК.
В отдельных случаях оказывается необходимо не ввести какой-нибудь новый ген в растение, а наоборот, заблокировать или ослабить действие природного гена. В качестве примера могут служить плоды томата, которые во время созревания содержат значительное количество специального белка PG, придающего плодам рыхлость. Для устранения этого белка в плоды вводят вектор, содержащий перевернутую копию его гена. В результате транскрипции получается антисмысловая (перевернутая) мРНК, которая комплиментарно связывается с нормальной мРНК. Образуется молекула двухцепочечной РНК, которая уже не может служить матрицей для синтеза белка. В результате получаются томаты с новыми свойствами плодов, которые тверже, дольше хранятся и более устойчивы к грибковым заболеваниям.
Не менее перспективным является направление по генной инженерии не ядерного генома, а генома пластид и митохондрий. В трансгенном материале значительно увеличивается содержание продукта за счет более активных метаболических процессов. Еще множество различных подходов, включая регуляцию активности генов, находятся на стадии разработки.
Обнаружение ГМ-продуктов с помощью CIM-монолитных колонок для выделения ДНК
Для выявления ГМ–продуктов был предложен новый метод с использованием CIM-колонок (Convective Interaction Media), основанный на выделении ДНК из тестируемых продуктов с последующей ее идентификацией.
Доступность достаточного количества ДНК нужного качества является существенным фактором в тех случаях, когда для обнаружения генетически измененных организмов используются методы, основанные на полимеразной цепной реакции (PCR). Было проведено исследование по изучению возможности применения анионно-обменных монолитных CIM-колонок (Convective Interaction Media; BIA Separations, Ljubljana, Slovenia) для выделения ДНК из пищевых продуктов. В качестве пищевых препаратов были выбраны кукуруза, ее производные и продукты из них, а также предварительно термически обработанные продукты из зерен кукурузы.
Были испытаны 2 коммерческие дисковые CIM-колонки: ДЭАЭ (диэтиламиноэтил) и QA (четвертичные амины). Предварительные разделения были проведены для стандартного раствора ДНК лосося при разных значениях рН и разных концентрациях NaCl в подвижной фазе. Были выбраны ДЭАЭ – группы и рН=8 для дальнейшего выделения ДНК из сложного исходного экстракта, полученного из изучаемых продуктов. Количество и качество изолированной ДНК было протестировано с использованием электрофореза в агарозном геле, УФ-сканирующей спектрометрии и усиления PCR-методом в режиме реального времени. ДНК, полученная таким путем, была удовлетворительного качества для проведения дальнейшего PCR-анализа
Описанный метод также применим для выделения ДНК из продуктов, подвергнутых обработке, с меньшим содержанием ДНК. Следует отметить, что этот новый метод более эффективен и требует меньше времени по сравнению с существующими методами по выделению ДНК из продуктов, произведенных из ГМ-растений.
Способы выявления ГМ-ингридиентов в колбасе
Почти 90 процентов колбас содержит в себе сою. А именно это растение на сегодняшний день является лидером по генным модификациям. Соевый белок используется во многих продуктах. Если есть соя в колбасе, то вероятность того, что она генно-модифицирована, составляет около 70 процентов. Если вы видите, что на упаковке колбасы указано, что продукт не содержит сои, то это лукавство. Колбасы без сои можно сделать только в домашних условиях. В массовых производствах это невозможно.
Список использованной литературы
1. Альбертс Б., Брей Д., Льюис Д. и др. Молекулярная биология клетки. М., Мир. 1994.
2. Глеба Ю.Ю. Биотехнология растений. Соросовский образовательный журнал. 1998, Т. 4, № 6, С. 3–8.
3. Грин Н., Стаут У., Тейлор Д. Биология. М., Мир. 1996.
4. Инге-Вечтомов С.Г. Генетика с основами селекции. М., Высшая школа. 1989.
5. Лещинская И.Б. Генетическая инженерия. Соросовский образовательный журнал. 1996, Т. 2, № 1, С. 32–39.
6. Лещинская И.Б. Современная промышленная микробиология. Соросовский образовательный журнал. 2000, Т. 6, № 4, С. 14–18.
7. Лутова Л.А., Павлова З.Б., Иванова М.М. Агробактериальная трансформация как способ изменения гормонального метаболизма у высших растений. Генетика. 1998, Т. 34, С. 165–182.
8. Лутова Л.А. Генетическая инженерия растений: свершения и надежды. Соросовский образовательный журнал. 2000, Т. 6, № 10, С. 10–17.
9. Льюин Б. Гены. М., Мир. 1987.
10. Рекомбинантные молекулы: значение для науки и практики. Ред. Бирс Р., Бэсит Э. М., Мир. 1980.
11. Семенова М.Л. Зачем нужны трансгенные животные. Соросовский образовательный журнал. 2001, Т. 7, № 4, С. 13–20.
12. Сингер М., Берг П. Гены и геномы. М., Мир. 1998.