Рефераты по авиации и космонавтике
Рефераты по административному праву
Рефераты по безопасности жизнедеятельности
Рефераты по арбитражному процессу
Рефераты по архитектуре
Рефераты по астрономии
Рефераты по банковскому делу
Рефераты по сексологии
Рефераты по информатике программированию
Рефераты по биологии
Рефераты по экономике
Рефераты по москвоведению
Рефераты по экологии
Краткое содержание произведений
Рефераты по физкультуре и спорту
Топики по английскому языку
Рефераты по математике
Рефераты по музыке
Остальные рефераты
Рефераты по биржевому делу
Рефераты по ботанике и сельскому хозяйству
Рефераты по бухгалтерскому учету и аудиту
Рефераты по валютным отношениям
Рефераты по ветеринарии
Рефераты для военной кафедры
Рефераты по географии
Рефераты по геодезии
Рефераты по геологии
Рефераты по геополитике
Рефераты по государству и праву
Рефераты по гражданскому праву и процессу
Рефераты по кредитованию
Рефераты по естествознанию
Рефераты по истории техники
Рефераты по журналистике
Рефераты по зоологии
Рефераты по инвестициям
Рефераты по информатике
Исторические личности
Рефераты по кибернетике
Рефераты по коммуникации и связи
Рефераты по косметологии
Рефераты по криминалистике
Рефераты по криминологии
Рефераты по науке и технике
Рефераты по кулинарии
Рефераты по культурологии
Реферат: Свойства твердых тел
Реферат: Свойства твердых тел
Федеральное агентство железнодорожного транспорта
Иркутский государственный университет путей сообщения
Реферат по физике
Свойства твердых тел
Выполнил студент
группы И-07-1-119
Налётов В.И
г. Иркутск
2009г.
Твердые тела
Отличие твердых тел (и жидкостей) от газов заключается в том, что при незначительных изменениях объема в твердых телах (и жидкостях) возникают значительные силы упругости, тогда как в газах даже при значительном изменении объема (до определенного предела) увеличения сил упругости почти не происходит. От жидкостей твердые тела отличаются тем, что силы упругости в них возникают и при изменении формы (сдвиг), чего не происходит в жидкости, способной принимать любую форму.
Твердые тела могут существовать в двух различных состояниях — кристаллическом и аморфном.
Аморфными называются тела, физические свойства которых одинаковы по всем направлениям (так называемая изотропность). Примерами аморфных тел могут служить куски затвердевшей смолы, янтарь, изделия из стекла. Изотропность физических свойств аморфных тел объясняется беспорядочностью расположения составляющих их атомов и молекул. Кристаллическое состояние характеризуется упорядоченным расположением атомов или молекул, которые образуют периодически повторяющуюся внутреннюю структуру. Физические свойства кристаллических тел неодинаковы в различных направлениях, но совпадают в параллельных направлениях. Это свойство кристаллов называется анизотропностью. Причиной анизотропности является то, что при упорядоченном расположении атомов, молекул или ионов силы взаимодействия между ними и межатомные расстояния оказываются неодинаковыми по различным направлениям.
Кристаллические тела делятся на монокристаллы, у которых внутренняя структура периодически повторяется во всем их объеме, и поликристаллы, представляющие собой множество сросшихся между собой хаотически расположенных маленьких кристаллов — кристаллитов.
Частицы, составляющие кристалл, расположены в определенном порядке и на определенном расстоянии друг от друга. Совокупность узлов, т.е. точек, совпадающих с центрами атомов или молекул, составляющих кристалл, называют кристаллической решеткой данного кристалла. Многие каркасы зданий и мостов, транспортные средства, линии электропередач и так далее сделаны из металлов, имеющих кристаллическую структуру. Поэтому большой практический интерес представляют вопросы прочности кристаллических тел. Как выяснилось, реальная прочность кристаллов во много раз меньше расчетной из-за наличия внутренних и поверхностных дефектов в кристаллической решетке. О механических свойствах твердых тел подробнее можно прочесть в главе, посвященной механике твердого тела
Точечные дефекты возникают при замещении собственного атома чужеродным, внедрении атома в пространство между узлами решетки или при отсутствии атома в одном из узлов кристаллической решетки.
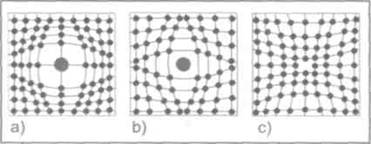
Рис. 1. Примеры точечных дефектов: а) замещение собственного атома чужеродным, Ь) внедрение атома в пространство между узлами кристаллической решетки, с) отсутствие атома в одном из узлов кристаллической решетки
Линейные дефекты возникают при нарушении в порядке расположения атомных плоскостей в кристаллах.

Рис. 3. Пример линейного дефекта в кристаллической решетке
Растворы и кристаллы
Зарождение и рост кристаллов
С миром кристаллов, чудесным и разнообразным, человек встречается на каждом шагу, например когда добавляет в чай мелкие кристаллики сахарного песка. Поваренная соль, без которой не обходится ни одна хозяйка, также состоит из отдельных маленьких частичек, хотя в природе встречаются большие прозрачные кристаллы каменной соли NаС1, немного похожие на хрусталь. Зимой лужи покрываются тонким слоем льда — это кристаллическая вода.
Многогранная натура кристаллов. Атомы, молекулы или ионы располагаются в кристаллических телах упорядоченно — в вершинах многогранников, а иногда в середине граней или в центре самого многогранника. Складывая вместе множество таких многогранников, можно получить кристалл в целом.
Французский ученый и морской офицер Огюст Браве (1811 — 1863) представил кристалл в виде решетки, в пересечениях прутьев которой размещаются слагающие ее частицы. Упорядоченное расположение частиц в узлах кристаллической решетки и придает кристаллу красивую, правильную и симметричную форму. В кристаллической решетке можно перемещаться в разных направлениях: вдоль, поперек, а также по диагонали. При этом количество частиц в узлах решетки, которые встречаются на пути, окажется разным. В этом причина анизотропии (от греч. «анизос» — «неравный» и «тропос» — «направление»; зависимость свойств от направления) кристалла. Например, значения электропроводности, показателя преломления, теплопроводности связаны с направлением, в котором они измерены.
У аморфных тел, частицы которых расположены в пространстве неупорядоченно, анизотропия отсутствует.
Как рождаются и растут кристаллы? Чтобы начался рост кристалла, необходимо прежде всего возникновение центра кристаллизации.
Как же он появляется? В совершенно прозрачном растворе, расплаве или в парах вещества протекает бурная «жизнь»: каждое мгновение частицы (ионы или молекулы) сталкиваются, и иногда при этом появляются мельчайшие зародыши будущего кристалла. Они недолговечны и, едва возникнув, разрушаются. Но однажды два-три зародыша, случайно столкнувшись, приобретают структуру элементарной ячейки — мельчайшего кристаллика вещества. Это скопление частиц уже не разрушается и начинает расти. Так появляется центр кристаллизации.
В его роли могут выступать и попавшие в раствор пылинки, дефекты поверхности сосуда, в котором находится раствор, либо внесенный извне кристаллик растворенного вещества. Это может быть и кристаллик другого вещества (при условии, что он обладает сходной кристаллической структурой).
Не все центры кристаллизации в конечном счете превращаются в кристаллы вещества. Крупные кристаллы продолжают расти, а более мелкие растворяются.
Совершенство формы и красота плоских граней кристаллов наводят на мысль, что эти «каменные цветы» растут слоями. Очень часто это действительно так, причем рост каждого слоя частиц начинается от центра грани кристалла. Большое увеличение позволяет увидеть ступеньки, размеры которых уменьшаются при переходе от этажа к этажу, как кольца в детской игрушке — пирамидке. Что произойдет, если какая-то частица вещества случайно попадет на грань мельчайшего кристалла, находящегося в пересыщенном растворе, расплаве или газе? Образовавшийся бугорок может положить начало новому слою, и весьма вероятно, что другие частицы устремятся именно сюда, обеспечивая формирование слоя и рост кристалла.
Кристалл растет быстрее, если частицы попадают на его поверхность не поодиночке, а целыми скоплениями, «толпами». Такие скопления затем разрастаются по горизонтали, покрывая поверхность кристалла, и в нем появляется новый слой частиц...
Кристаллы из вулканов и Озер. В природе кристаллы зарождаются и растут очень медленно. Все минералы и горные породы в недрах Земли образовались при кристаллизации магмы — расплавленной массы, насыщенной газами и перегретым водяным паром. При охлаждении магмы в первую очередь выделяется вещество с наиболее высокой температурой плавления (в отличие от аморфных тел, температура плавления кристаллических веществ имеет вполне определенное значение): образуются зародыши, постепенно вырастающие в правильные многогранники.
Когда они становятся достаточно большими и начинают мешать друг другу, вместо отдельных монокристалликов образуется их конгломерат, и тогда можно говорить о поликристаллической структуре. Вещество с более низкой температурой плавления дает мелкие кристаллы: ведь часть пространства уже занята выделениями высокоплавкого компонента.
В соляных озерах вода на вкус горько-соленая: ведь в ней растворены, помимо поваренной, и другие соли. Летом, когда светит солнце, часть воды испаряется, раствор становится пересыщенным, а кристаллы солей выпадают в осадок, плавают на поверхности, оседают на любых предметах, попавших в такое озеро. Кристаллы хлорида натрия NaСl могут срастаться друг с другом.
Медленная кристаллизация в течение столетий приводит к образованию крупных кристаллов каменной соли (хлорида натрия). В пустыне Сахара сохранились развалины древнего города, возведенного из глыб этого своеобразного строительного материала. Город простоял много лет, ведь в пустыне практически не бывает дождей.
Подобные явления происходят и в природных условиях. Например, самородная сера образуется при охлаждении паров, выделяющихся из кратеров или трещин вулканов. Аналогичен «жизненный путь» многих других веществ, входящих в состав минералов.
Информация:
Химия от А до Я
Байер, Адольф-Иоганн-Фридрих-Вильгельм (1835—1917) — немецкий химик-органик, первым использовал восстановительные свойства цинка в органическом синтезе.
Бекетов, Николай Николаевич (1827— 1911) — российский физикохимик, разработал теорию водородной связи.
Бензойная кислота – органическая кислота состава С6Н5СООН.
Бензол — ароматический углеводород состава С6Н6.
Берлинская лазурь — гексацианофер-рат железа-калия КFе[Fе(СN)6].
Бертло, Пьер-Эжен-Марселен (1827— 1907) — французский химик, один из основоположников органического синтеза и термохимии; ввел понятие об экзотермических и эндотермических реакциях.
Берцелиус, Йёне-Якоб (1779-1848) -шведский химик и минералог, выдающийся экспериментатор и теоретик химии, первооткрыватель новых химических элементов и соединений.
Бессемер, Генри (1813-1898) — английский металлург и инженер, изобретатель конвертера для передела чугуна в сталь.
Бета-частица — электрон как продукт радиоактивного распада.
Бутадиен — непредельный углеводород состава С4Н6 с двумя двойными связями в молекуле.
Бутлеров, Александр Михайлович
(1828—1886) — русский химик, создатель теории химического строения.

Рис. 4. Кристаллы имеют правильную и красивую форму, например октаэдрическую (слева) или пластинчатую (справа).
При быстром охлаждении вещества могут кристаллизоваться из пара, минуя жидкое состояние. Тогда и в комнате может неожиданно пойти... снег! Подобный случай, кстати, был описан в «Санкт-Петербургских ведомостях» за 1773 г. Во время бала в помещении было настолько жарко и душно, что затянутые в корсет дамы начали падать в обморок. Один находчивый офицер выбил оконное стекло: ведь в этом зале форточек не было. Стало немного прохладнее, но, к изумлению присутствующих, от ворвавшегося морозного воздуха в зале хлопьями повалил снег...
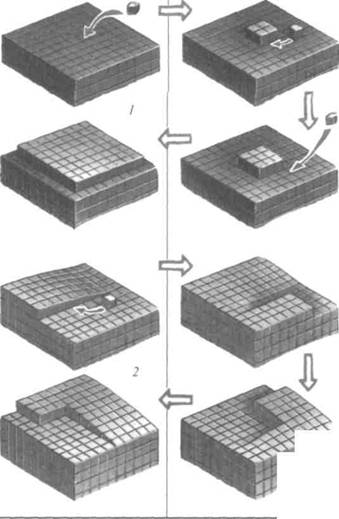
Рис. 5. Два типа роста кристаллов:
1— от центра грани;
2— ступеньками
Рукотворные драгоценности. Драгоценные камни всегда манили и привлекали к себе людей. Возникла задача «рукотворного» получения драгоценных камней. Синтез искусственного кварца основан на кристаллизации из раствора. Различные добавки позволяют получить настоящую россыпь драгоценных камней. Темно-дымчатая окраска кварца-мориона обусловлена примесью алюминия, причем готовые кристаллы подвергают рентгеновскому облучению для проявления окраски. Цвет голубого кварца (перунита) обусловлен примесями кобальта. Аметистовая окраска кварца вызывается атомами железа в необычной степени окисления + lV. Они замещают атомы кремния в кварце. При малом содержании ионов железа в кварце окраска искусственных аметистов бурая, а при высоком — зеленая. Цвет зависит даже от того, каким образом распределены атомы железа в кристалле. Для проявления аметистовой окраски кристаллы облучают.
Твердые растворы и жидкие кристаллы
Когда человек берет в руки ложку или вилку из нержавеющей стали или же, гуляя, проходит мимо бронзового памятника на бульваре, ему и в голову не приходит, какие удивительные вещества — металлические сплавы. А ведь это твердые растворы разных металлов друг в друге. Нержавеющая сталь, например, кроме железа содержит еще хром, никель и марганец, а бронза, помимо меди, включает олово и свинец.
Металлические растворы. Твердые растворы получаются, когда в кристаллической решетке одного вещества — не обязательно металла — без изменения ее строения располагаются атомы или ионы другого вещества. Например, в кристалле металлического серебра А§ все атомы можно последовательно заменить атомами золота Аи. Кристаллическая решетка при этом останется по существу прежней, только вместо одного металла (серебра) сначала получается ряд сплавов со все растущим содержанием золота и, наконец, второй металл (чистое золото). В этом случае химики говорят, что образуется «неограниченный твердый раствор» или что золото и серебро неограниченно растворимы друг в друге.
Химическая диковинка: жидкие кристаллы. Жидкие кристаллы действительно существуют — это вещества, обладающие свойствами и жидкостей, и кристаллов. Их даже нельзя считать «химической редкостью», поскольку из каждой тысячи новых органических веществ, синтезируемых в лабораториях мира, по крайней мере пять — жидкие кристаллы. По механическим свойствам это вещества более или менее текучие, а в оптическом отношении они в точности повторяют свойства кристаллов.
Жидкие «нитки» и холестерин. Второй тип жидкокристаллических веществ называется нематическим (от греч. «нема» — «нить»). Эти вещества содержат нитевидные частицы, которые либо прилипают к стенкам сосуда, либо остаются свободными. Эти нити выглядят «причесанными» и направлены параллельно друг другу, но могут скользить вверх и вниз. Подходящая аналогия для нематических жидких кристаллов — длинная коробка с короткими карандашами, которые могут свободно поворачиваться вокруг своей оси, перемещаться вдоль коробки, но никогда не встают поперек.
Столь своеобразное строение — причина совершенно необычных оптических свойств холестерических жидких кристаллов. Обычный (неполяризованный) свет, проходя через такие вещества, распадается на два луча, которые преломляются по-разному. Когда бесцветный, как вода, холестерический жидкий кристалл попадает в зону пространства с меняющейся температурой, он начинает принимать удивительно яркую окраску. Кристалл может стать сначала фиолетовым, затем голубым, зеленым, желтым, красным и, наконец, опять бесцветным.
Сейчас с жидкокристаллическими индикаторами человек сталкивается практически ежедневно, глядя на циферблаты электронных часов и калькуляторов, экран переносного компьютера — «ноутбука», электронные табло на вокзалах и в аэропортах, на рекламные щиты с «живым» изображением.

Рис. 10. Колебания видимого света в слоях холестерического жидкого кристалла
Широко известен случай, связанный с золотой короной древнегреческого царя Гиерона. Легенда гласит, что, решая поставленную перед ним задачу — определить подлинность короны из золота, — древнегреческий ученый Архимед (около 287—212до н.э.) открыл закон, который увековечил его имя: «Всякое тело, погруженное в жидкость, теряет в своем весе столько, сколько весит вытесненная им жидкость»
Кристаллы аметистового цвета. Можно за две-три недели вырастить красивые кристаллы твердых растворов солей и у себя дома. Для этого потребуются стеклянная банка, проволока и нитка, да еще необходимый запас солей, кристаллы которых вы собираетесь выращивать. Эффектно выглядят «доморощенные» кристаллы чистых алюмокалиевых и хромокалиевых квасцов (бесцветные либо фиолетовые октаэдрические многогранники), и очень хороши такие же октаэдрические кристаллы нежно-сиреневого цвета, которые вырастают из раствора смеси этих солей.
Сначала готовят как можно более концентрированный раствор соли или смеси солей и наливают его в банку, а потом с помощью проволочной перемычки подвешивают в растворе на нитке кристаллическую «затравку»- маленький кристаллик. На этой «затравке» и предстоит расти будущему экспонату коллекции кристаллов. Банку, не закрывая, ставят в теплое место. Когда кристалл станет достаточно большим, его вынимают, обсушивают мягкой тряпочкой или бумажной салфеткой, обрезают нитку и покрывают грани бесцветным лаком, чтобы предохранить от «выветривания» на воздухе.
Достижения в коллоидной химии, на первый взгляд чисто теоретические, многое прояснили в атомно- молекулярном строении вещества и заложили основы методов будущих исследований живой клетки. Ведь не только кровь и протоплазма клеток, но и все растительные и животные ткани- это сложные коллоидно-химические системы.
Расплавы-«пирозоли», содержащие распределенные в них частицы «коллоидных» размеров, при охлаждении кристаллизуются или застывают без образования кристаллов, образуя «стекла». Полученные твердые золи- это цветные стекла (например, рубиновые), эмали, наконец, многие из драгоценных и полудрагоценных камней.