Рефераты по авиации и космонавтике
Рефераты по административному праву
Рефераты по безопасности жизнедеятельности
Рефераты по арбитражному процессу
Рефераты по архитектуре
Рефераты по астрономии
Рефераты по банковскому делу
Рефераты по сексологии
Рефераты по информатике программированию
Рефераты по биологии
Рефераты по экономике
Рефераты по москвоведению
Рефераты по экологии
Краткое содержание произведений
Рефераты по физкультуре и спорту
Топики по английскому языку
Рефераты по математике
Рефераты по музыке
Остальные рефераты
Рефераты по биржевому делу
Рефераты по ботанике и сельскому хозяйству
Рефераты по бухгалтерскому учету и аудиту
Рефераты по валютным отношениям
Рефераты по ветеринарии
Рефераты для военной кафедры
Рефераты по географии
Рефераты по геодезии
Рефераты по геологии
Рефераты по геополитике
Рефераты по государству и праву
Рефераты по гражданскому праву и процессу
Рефераты по кредитованию
Рефераты по естествознанию
Рефераты по истории техники
Рефераты по журналистике
Рефераты по зоологии
Рефераты по инвестициям
Рефераты по информатике
Исторические личности
Рефераты по кибернетике
Рефераты по коммуникации и связи
Рефераты по косметологии
Рефераты по криминалистике
Рефераты по криминологии
Рефераты по науке и технике
Рефераты по кулинарии
Рефераты по культурологии
Контрольная работа: ДНК. Основы генетического материал
Контрольная работа: ДНК. Основы генетического материал
Челябинский Государственный Университет
Юридический факультет
Контрольная работа
По предмету: «Концепции современного естествознания»
На тему: «ДНК. Основы генетического материал»
Выполнил:
студент гр. ЗЮ-
Проверил:
____________________
Челябинск 2009
Содержание
Введение
1. Общие понятия о дезоксирибонуклеиновых кислотах
2. Способы получения ДНК
3. Химический состав и физико-химические свойства ДНК
4. Методы количественного и качественного определения и исследования
5. Содержание в клетках и тканях
6. Биосинтез
7. Биологическая роль
8. Гистохимические методы обнаружения в тканях
Заключение
Литература
Введение
Нуклеиновые кислоты имеют первостепенное биологическое значение и представляют собой сложные высокомолекулярные биополимеры, мономерами которых являются нуклеотиды.
Они впервые были обнаружены в ядрах клеток, откуда и их название (нуклеус — ядро).
Существует два типа нуклеиновых кислот: дезоксирибонуклеиновая (ДНК) и рибонуклеиновая.
Важные открытия были сделаны учеными, они открыли молекулу ДНК. На основе этой молекулы строится вся жизнь.
Немного из истории. ДНК впервые были открыты Мишером (F. Micscher, 1869), который назвал полученное вещество нуклеином (лат. nucleus ядро). Впоследствии было показано, что нуклеин представляет собой высокомолекулярную, содержащую фосфор кислоту, находящуюся в комплексе с белками, поэтому стали различать собственно нуклеиновую кислоту [Альтманн (R. Altmann), 1889] и ее комплексы с белками — нуклеопротеиды. Вскоре нуклеиновая кислота была получена из вилочковой железы (тимуса) теленка, оказавшейся богатым источником итого вещества. Вещество, близкое но свойствам, но отличающееся от нуклеиновой кислоты, полученной из тимуса, выделили из дрожжей. Выяснилось, что нуклеиновая кислота из дрожжей содержит аденин, гуанин, цитозин и урацил, тогда как нуклеиновая кислота. выделенная из тимуса теленка, вместо урацила содержит тимин. В качестве углеводного компонента в дрожжевой нуклеиновой кислоте нашли пентозу, а в препарате из тимуса — дезоксипентозу. В зависимости от источника получения эти нуклеиновые кислоты получили названия тимонуклеиновой и зимонуклеиновой. Поскольку первый тип нуклеиновой кислоты находили в животных объектах, а второй — в растительных, употребляли также названия «животная» и «растительная» нуклеиновые кислоты. Однако, когда Фейльген (R. Feulgen) разработал гистохимическую реакцию на «животную» нуклеиновую кислоту, оказалось, что она обнаруживается в ядре как животных, так и растительных клетоколо С другой стороны, «дрожжевая» нуклеиновая кислота была найдена Ж. Браше главным образом в цитоплазме клеток и растений, и животных. Наконец, А. Н. Белозерским наличие ДНК у растений было доказано химически. Названия «дезоксирибонуклеиновая кислота» (ДНК) и «рибонуклеиновая кислота» (РНК) были предложены после того, как Левином (Р.A. Levenе) было установлено, что дезоксипентоза в тимонуклеиновой кислоте является дезоксирибозой, а пентоза в зимонуклеиновой кислоте — рибозой.
1. Общие понятия о дезоксирибонуклеиновых кислотах
Дезоксирибонуклейновые кислоты (ДНК; устаревшие названия: дезоксипентозонуклеиновые кислоты, ядерные нуклеиновые кислоты, тимонукленновые кислоты, животные нуклеиновые кислоты) — нуклеиновые кислоты, содержащие в качестве углеводного компонента дезоксприбозу, а в качестве одного из пиримидиновых оснований — тимин, которым в молекулах рибонуклеиновых кислот соответствуют рибоза и урацил. ДНК представляют собой линейные полимеры дезоксирибонуклеотидов, в последовательности азотистых оснований которых закодирована вся наследственная информация.
Таким образом, ДНК данного организма содержит в себе информацию о всех признаках вида и особенностях индивидуума — его генотип — и передает эту информацию потомству, воспроизводя определенную последовательность оснований в строении индивидуальных ДНК. Поскольку молекулы ДНК очень больших размеров и существует огромное множество возможных неодинаковых последовательностей из четырех различных нуклеотидов, число разных молекул ДНК практически бесконечно.
В природе ДНК содержатся во всех организмах за исключением РНК-содержащих вирусов. ДНК являются типичным компонентом клеточного ядра, в котором они находятся в комплексе с белками, главным образом гистонами, образуя дезоксприбонуклеопротеиды, составляющие основу цитологической структуры хроматина и вещества хромосом. ДНК обнаружена также в хлоропластах растительной клетки и в митохондриях животных и растений, в которых она кодирует часть белков этих структур, благодаря чему они обладают некоторой автономией и лишь частично зависят от ДНК ядра.
2. Способы получения ДНК
Методика выделения ДНК зависит от состава и характера используемого источника (ткани животных или растений, микроорганизмы, вирусы). Для лабораторного и промышленного получения ДНК обычно используют вилочковую железу теленка, а также сперму (молоки) рыб, селезенку млекопитающих, ядерные эритроциты птиц.
Препараты ДНК, получаемые обычно в виде натриевой соли ДНК, имеют вид белых волокон. Для сохранения нативных свойств ДНК обработку тканей и клеток проводят на холоду, по возможности быстро, в условиях, исключающих или уменьшающих действие дезоксирибонуклеаз, как правило, содержащихся в тканях и вызывающих ферментативный распад ДНК. Помимо сохранения нативных свойств, важнейшей задачей является очистка ДНК от других веществ, в первую очередь — от белков и РНК. В связи с этим методы получения ДНК различаются главным образом способами депротеинизации и очистки препаратов от примесей РНК. Для этих целей применяют обработку клеток и тканей различными детергентами, фенолами и другими депротеинизирующими агентами.
При получении ДНК из животных и растительных тканей чаще всего предварительно изолируют фракцию клеточных ядер или выделяют дезоксирибонуклеопротеиды, отмывая их солевыми растворами в физиологических концентрациях в присутствии ЭДТА или других соединений, связывающих двухвалентные катионы, необходимые для проявления ферментативной активности дезоксирибонуклеаз. После удаления основной массы белков препараты дополнительно депротеинизируют хлороформом с октанолом или фенолом. Нередко их обрабатывают также рибонуклеазами и протеолитическими ферментами, обычно проназой.
Для получения ДНК из бактерий обычно пользуются методом Мармура. который заключается в отмывании бактериальной массы 0,15 М Nad, содержащим 0,015 М цитрат натрия, лизисе клеток при 60° и рН 8,0 в 0,15 М NaCI, содержащем ЭДТА и 2% додецилсульфат натрия, депротепнизации их хлороформом, содержащим изоамиловый спирт, переосаждении спиртом, повторной многократной депротеинизации, обработке рибонуклеазой и осаждении изопропиловым спиртом. Этот метод в различных модификациях также успешно применяют для получения ДНК из животных и растительных тканей и изолированных клеточных структур, например, митохондрий.
3. Химический состав и физико-химические свойства ДНК
ДНК представляют собой многоосновные сильные кислоты, щелочные соли которых образуют в воде очень вязкие прозрачные коллоидные растворы, застывающие при концентрации выше 0,25%. Растворы ДНК характеризуются аномальной (структурной) вязкостью, объясняющейся удлиненной формой молекул, и в потоке обладают двойным, лучепреломлением.
Химически ДНК представляют собой высокомолекулярные полимеры монодезоксирибонуклеотидов (мононуклеотидов), являющиеся мономерами, из которых построены молекулы
ДНК. Каждый мононуклеотид ДНК состоит из остатков фосфорной кислоты, 2-П-дезоксирибозы и пуринового или пиримидинового азотистого основания. Углеводно-фосфатный остаток одинаков во всех мономерах ДНК, азотистое основание же может быть представлено аденином (А), гуанином (Г), цитозином (Ц) или тимином (Т). В ДНК разных организмов имеется некоторое количество так называемых, минорных оснований, например 5-метил-цитозина, частично заменяющего цитозин. У высших животных и человека содержание этого основания достигает 1,5%, у высших растений 5—7% , у бактерий — не более 0,6% . В ДНК бактерий встречается также 6-метиладенин и иногда другие метилированные азотистые основания. В ДНК Т-четных бактериофагов (Т2, Т4 и Т6) цитозин полностью замещен 5-оксиметилцитозином, в ДНК вирусов SP01 и SP8 тимин замещен 5-оксиметилурацилом, а у фага PBS1 — урацилом.
В мононуклоотидах 2-П-дезокси-рибоза присоединена гликозидной связью через первый углеродный атом к атому азота в 9-м положении пуринового основания (аденина или гуанина) или в 3-м положении пиримидинового основания (цитозина или тимина). Остаток фосфорной кислоты присоединен эфирной связью к 5'-му или З'-му атому углерода дезоксирибозы. Таким образом, мононуклеотидные остатки соединены между собой через фосфорную кислоту, которая соединена с 5'-С-атомом дезоксирибозы одного нуклеотида и с 3'-С-атомом дезоксирибозы соседнего нуклеотида и т. д. (схема 1).
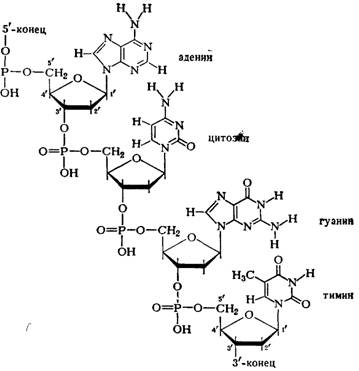
Схема 1. Соединение нуклеотидов в молекуле ДНК.
ДНК из различных источников отличаются друг от друга по соотношению входящих в их состав азотистых оснований, то есть по нуклеотидному составу, однако нуклеотидный состав всех ДНК подчиняется определенным закономерностям — правилам Чаргаффа, согласно которым:
1) число молекул аденина равно числу молекул тимина; 2) число молекул гуанина равно числу молекул цитозина; 3) число молекул пуриновых оснований равно числу молекул пиримидиновых оснований;
4)
число 6-аминогрупп в молекуле ДНК равно числу 6-кетогрупп, то есть сумма аденин
+ цитознн равна сумме гуанин + тимин. Записав правила Чаргаффа буквенными
обозначениями, получим следующие выражения: 1) А - Т; 2) Г - Ц; 3) А + Г = Т +
Ц; 4) А + Ц = Г + Т. Эти правила сохраняют силу и в том случае, если
приведенные азотистые основания замещены их метилированными или другими
производными (минорными основаниями). Таким образом, нуклеотидный состав ДНК
характеризуется молярным отношением ![]() (фактором специфичности) или
процентом ГЦ-пар, т.е.
(фактором специфичности) или
процентом ГЦ-пар, т.е. ![]() . Величина этого показателя
одинакова для ДНК различных органов и тканей одного организма и практически не
отличается у разных видов животных и растений в пределах одного класса. Она
достаточно близка у высших растений и животных (позвоночных) — от 0,55 до 0,93.
У бактерий, по данным А. С. Спирина и А. Н. Белозерского, величина
фактора специфичности колеблется от 0,35 до 2,73 или от 26,8 до 74,2% ГЦ-пар.
. Величина этого показателя
одинакова для ДНК различных органов и тканей одного организма и практически не
отличается у разных видов животных и растений в пределах одного класса. Она
достаточно близка у высших растений и животных (позвоночных) — от 0,55 до 0,93.
У бактерий, по данным А. С. Спирина и А. Н. Белозерского, величина
фактора специфичности колеблется от 0,35 до 2,73 или от 26,8 до 74,2% ГЦ-пар.
Рентгеноструктурный анализ ДНК показал, что пуриновые и пиримидиновые основания нуклеотидных остатков ДНК лежат в одной плоскости, перпендикулярной продольной оси молекулы, тогда как циклы дезоксирибозы находятся в плоскости, почти перпендикулярной той, в которой лежат циклы оснований. Расстояния между азотистыми основаниями отдельных нуклеотидов составляют 3,4 А. В соответствии с этими данными и с правилами Чаргаффа Дж. Уотсон и Ф. Крик построили модель молекулы ДНК (схема 2). Дальнейшие исследования подтвердили их правоту. Установление строения молекулы ДНК явилось крупнейшим открытием в области молекулярной биологии. Согласно модели Уотсона - Крика, молекула ДНК представляет собой двойную спираль, построенную из двух полинуклеотидных цепочек, направленных антипараллельно, то есть если в одной цепочке остаток фосфорной кислоты связывает отдельные нуклеотиды от 5'- к 3'-С-атомам снизу вверх, то в другой цепочке эти связи направлены сверху вниз. Каждая цепочка состоит из углеводно-фосфорного скелета, присоединенные к углеводному компоненту азотистые основания ориентированы внутрь и соединены между собой попарно водородными связями, а именно А– с Т и Г – с Ц. Аденин с тимином соединены двумя Н-связями, тогда как гуанин с цитозином соединены еще третьей водородной связью (схема 3). Двойная спираль закручена вправо, причем полному витку спирали соответствуют 10 пар нуклеотидных остатков, занимающих расстояние в 34 А,— В-форма. В-форма устойчива в среде с высокой влажностью (97% насыщенного пара). Вся молекула ДНК представляет собой жесткий, неветвящийся линейный полимер. В условиях низкой влажности (с 76% насыщения) двойная спираль ДНК принимает А-форму, в которой полный виток спирали занимает расстояние в 28 А, причем меняется также положение плоскости, в которой расположены азотистые основания, и число оснований на полный виток (один виток содержит 11 нуклеотидов).
В хроматине ДНК образует комплексы с гистонами. Такие нуклеогистоны находятся в сверхспирализованном состоянии, причем суперспираль имеет радиус 50 А и расстояние между витками 120 А. В хромосомах и частично в хроматине такие суперспирали дезоксирибонуклеопротеида закручены в спирали высших порядков с диам. 250 и 500 А.
Молекулярный вес (масса) ДНК неодинаков и зависит от источников получения образца ДНК. Помимо этого, даже при самых тщательных и щадящих процедурах выделения ДНК подвергается некоторой деградации и ее молекулярный вес может быть ниже, чем в клетках. Препараты, получаемые современными методами из тканей животных н растений, имеют мол. вес 6-106—10-106, однако истинный мол. вес ДНК животных и растений, как показывают методы определения мол. веса по вязкости и по длине молекул (lA двуспиральной ДНК в В-форме соответствует 197 единицам молекулярного веса), значительно выше и может достигать десятков миллиардов. Таким образом. молекулы ДНК хромосом являются самыми крупными молекулами из всех известных биополимеров.
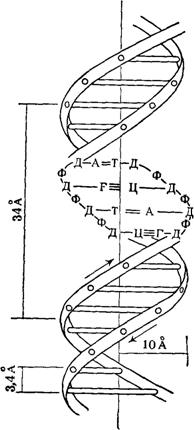
Схема 2. Двойная спираль молекулы ДНК (модель Уотсона—Крика): А — аденин; Т — тимин, Г — гуанин; Ц — цитозин; Д — дсзоксирибоза; Ф — фосфат; 34 А — величина витка, спирали; 10 А — радиус спирали; 3, 4 А — расстояние между нуклеотидами; стрелки указывают направление витка спирали.
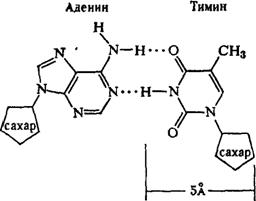
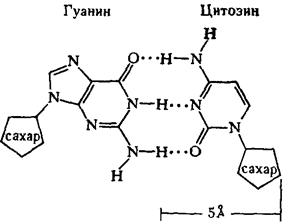
Схема 3. Соединение пуриновых и пиримидиновых оснований в молекуле ДНК (точками обозначены водородные связи).
У некоторых вирусов, например у бактериофагов Ф Х174, fd и М13, ДНК представлена одной полинуклеотидной цепью, замкнутой в кольцо и имеющей сравнительно небольшой мол. вес — 1,7-106. У большинства вирусов ДНК представляет собой двойную спираль, линейную пли замкнутую в кольцо; нередко такие формы переходят друг в друга, причем эти молекулы имеют так называемые «липкие концы», содержащие однонитчатые комплементарные друг другу нуклеотидные последовательности, при помощи которых молекула замыкается в кольцо. Для ДНК характерно сильное поглощение в ультрафиолетовой части спектра при длине волны около 260 нм. Удельное поглощение высокополимерной ДНК в растворе, содержащем выше 10-3 М NaCI, при рН 7,0 составляет около 6000 на 1 г-атом фосфора. ДНК сравнительно легко деполимеризуются под действием некоторых химических соединений, ультразвука, ионизирующей и ультрафиолетовой радиации; нагревание ДНК с разведенными минеральными кислотам приводит к отщеплению пуринов (аденина и гуанина) и образованию «апуриновой кислоты», содержащей только пиримидиновые основания. Нагревание растворов ДНК, а также их подщелачивание и т.п. вызывают денатурацию ДНК, заключающуюся в плавлении двойной спирали (разрыве водородных и гидрофобных связей) и расхождении полинуклеотидных цепочек. Денатурация сопровождается понижением вязкости раствора и повышением поглощения в ультрафиолете, по чему можно контролировать этот процесс. Температура плавления (температура, при которой денатурирована половина ДНК) тем выше, чем больший процент ГЦ-пар содержится в ДНК; этот показатель может служить для определения нуклеотидного состава ДНК. Установлено, что (не линейно связана с составом ДНК: 1° соответствует 2,5 молярным % ГЦ-пар. Гомогенные препараты ДНК (например, вирусной ДНК) характеризуются плавлением с резким переходом, тогда как гетерогенные препараты дают сравнительно широкую зону плавления, что может служить мерой гетерогенности ДНК. При быстром охлаждении после денатурации ДНК не восстанавливает своих нативных свойств, однако при медленном охлаждении полинуклеотидные цепочки реассоциируются по принципу комплементарности и таким образом происходит ренатурация молекул ДНК. При медленном охлаждении денатурированной ДНК в присутствии РНК полинуклеотидные нити ДНК и РНК могут ассоциироваться но принципу комплементарности пар гуанина с цитозином и аденина с урацилом (вместо тимина), образуя двунитчатые гибриды ДНК — РНК. Метод гибридизации широко применяется для исследования комплементарности и структуры двух типов нуклеиновых кислот, а также ДНК из разных источников. Изучение ренатурации ДНК показало, что ДНК высших организмов содержат повторяющиеся последовательности, которые можно разделить на очень часто повторяющиеся последовательности и относительно часто повторяющиеся. Кроме того, имеются и уникальные последовательности. К повторяющимся последовательностям, по-видимому, относятся регуляторные гены, а также гены, кодирующие рибосомные РНК, транспортные РНК и гистоны. Структурные гены, как правило, относятся к уникальным последовательностям, что доказано для таких активных генов, как гены глобина в эритробластах и гены фиброина в шелкоотделительной железе шелкопряда. У низших организмов (прокариотов) — вирусов и бактерий, а также в митохондриях ДНК не содержит или почти не содержит повторяющихся последовательностей. В ДНК ряда организмов обнаружены участки, в каждой из нуклеотидных цепей которых имеются последовательности оснований, повторяющиеся далее, но в обратном порядке. Поскольку такие последовательности читаются одинаково с обоих концов, как, например, слово «потоп», они получили название палиндромов. Палиндромы в ДНК и в синтезированных на их матрице РНК могут образовывать крестообразные структуры, физиологическую роль которых, возможно, связана с инициацией (началом) синтеза РНК или белков.
Методом молекулярной гибридизации показано, что в ядерной ДНК плодовой мушки Drosophila melanogaster около 75% всей ДНК представлено уникальными последовательностями, около 15% — очень часто (до 1 000 000 раз) повторяющимися и около 10% — относительно часто (1000—100 000 раз) повторяющимися нуклеотидными последовательностями. Очень часто повторяющиеся последовательности расположены главным образом в плотном хроматине, цитологически описываемом как гетерохроматин; они встречаются чаще всего в так называемой сателлитной ДНК, обычно отличающейся от основной массы ДНК по нуклеотидному составу и отделяемой от нее при равновесном центрифугировании в градиенте плотности хлористого цезия. Такие сателлиты содержатся почти у всех эукариотов и составляют от 1% до половины всей массы генома. Даже у близкородственных видов количество сателлитной ДНК может существенно отличаться. Относительно часто повторяющиеся последовательности распределены между гетеро- и эухроматином. Значительная часть дезоксирибонуклеопротеида хроматина состоит из чередующихся участков повторяющихся и уникальных последовательностей ДНК. Заметные количества ДНК, содержащей относительно часто повторяющиеся последовательности, находятся также в хроматине, ассоциированном с ядрышками и кодирующем рибосомные РНК.
Первичная структура ДНК трудно поддается изучению уже потому, что молекулы ДНК имеют огромные размеры. Некоторую информацию о последовательности нуклеотидов дает изучение пиримидиновых блоков. При обработке ДНК концентрированной муравьиной кислотой, содержащей дифениламин, происходит отщепление пуриновых оснований и дальнейший гидролиз ДНК. В молекуле сохраняются пиримидиновые последовательности, остающиеся в блоках, представляющих собой олигодезоксинуклеотиды, лишенные пуриновых мономеров. Такие блоки разделяют с помощью хроматографии на изоплиты — олигомеры, содержащие одинаковое число нуклеотидных остатков, затем их в свою очередь разделяют и анализируют. Подобным образом изучают пуриновые блоки, получаемые обработкой ДНК гидразином. Однако наибольший прогресс в изучении структуры ДНК достигнут в результате применения дезоксирибонуклеаз, расщепляющих определенные последовательности нуклеотидов, и в особенности рестриктаз, обладающих узкой специфичностью в отношении коротких нуклеотидных последовательностей в 6—7 нуклеотидов. Более детальную информацию в отношении нуклеотидной последовательности в молекулах ДНК, представляющих собой структурные гены, получают путем анализа нуклеотидной последовательности в соответствующих им РНК и белках. Удалось установить последовательность нуклеотидов в небольших молекулах сателлитной ДНК у высших организмов, выяснена также нуклеотидная последовательность в довольно значительных участках ДНК у некоторых вирусов, бактерий и др.
Метилирование азотистых оснований в составе ДНК происходит уже после синтеза молекулы и относится к так называемом постсинтетическим изменениям или модификациям.
У Е. coli метилируется аденин, находящийся как раз в той короткой последовательности нуклеотидов, которая «узнается» рестрикислотазой R1. По-видимому, рестриктазы избирательно разрушают чужеродные ДНК, попадающие в бактерию, в собственной же ДНК «узнаваемые» ими последовательности защищены метильными группами.
4. Методы количественного и качественного определения и исследования
Большинством цветных химических реакций ДНК обязаны своему углеводному компоненту — дезоксирибозе. Под действием кислот ДНК легко отщепляет пуриновые основания, причем освобождается альдегидная группа дезоксирибозы. В результате дальнейшего действия кислоты дезоксирибоза претерпевает превращения с образованием w-оксилевулинового альдегида: ответственного, по-видимому, за образование окраски с реактивами на ДНК.
Чаще других реакций для обнаружения и количественного определения ДНК применяют нагревание с дифениламином в концентрированной уксусной кислоте в присутствии концентрированной серной кислоты. Эту реакцию обычно применяют в модификации Бертона (К. Burton) при 30° в присутствии уксусного альдегида. Реже применяются менее чувствительные цветные реакции с цистеином, с триптофаном или индолом, а также с карбазолом. Иногда применяют также цветную реакцию с ганитрофенилгидразином. Весьма чувствительным является флюориметрический метод, позволяющий определять до 3.10-9 г ДНК.
Для количественного определения ДНК необходимо ее предварительное отделение от РНК и (по возможности) от других веществ, мешающих применяемой реакции. Для этих целей обычно пользуются методом Шмидта и Таннгаузера (G. Schmidt, S. J. Thannhauser) в различных модификациях. Принцип метода заключается в осаждении нуклеиновых кислот вместе с белками трихлоруксусной или хлорной кислотой, отмывании кислоторастворимых фосфорных соединений, экстрагировании липидов и извлечении нуклеиновых кислот при помощи гидролиза 5% трихлоруксусной кислотой при 90° в течение 15—20 мин. Белки при этом остаются в осадке; из раствора, содержащего нуклеиновые кислоты и подвергнутого гидролизу 0,3— 1,0 н. щелочью, вызывающей распад РНК до нуклеотидов, ДНК осаждают подкислением трихлоруксусной или хлорной кислотой. Осадок отмывают и ДНК экстрагируют горячей хлорной кислотой. Содержание ДНК определяют по фосфору, спектрофотометрически или при помощи специфических цветных реакций, но спекислотрофотометрический метод является наиболее простым и быстрым для определения ДНК после отделения ее от других веществ, характеризующихся максимумом поглощения при 260 нм.
При определении нуклеотидного состава ДНК последнюю подвергают гидролизу хлорной кислотой и отщепившиеся пуриновые и пиримидиновые основания разделяют хроматографией на бумаге или на ионообменниках. Хорошие результаты дает также хроматография в тонком слое на производных целлюлозы и др. Поскольку в обычных двуспиральных ДНК нуклеотидный состав подчиняется определенным правилам (правила Чаргаффа), он может быть выражен в виде процентного содержания ГЦ-пар. Молярный процент ГЦ-пар вычисляют, используя температуру плавления ДНК (температура, при которой денатурирована половина ДНК), по формуле: процент ГЦ-пар = 2,44 ((°пл — 69,3°). Коэффициенты, приведенные в формуле, рассчитаны эмпирически и варьируют в зависимости от ионной силы, ионного состава и величины рН раствора. Хорошие результаты при определении нуклеотидного состава ДНК дает метод улътрацентрифугирования в градиенте плотности хлористого цезия. Плавучая плотность ДНК при этом линейна связана с молярным содержанием ГЦ-пар (изменение содержания ГЦ-пар на 1% изменяет плавучую плотность на 0,001 единицы) и определяется по уравнению: молярное содержание ГЦ-пар = 10,2 .(р — 1,660), где р — плавучая плотность исследуемого препарата ДНК. Для чистых препаратов ДНК нуклеотидный состав можно определить также по спектру поглощения в 0,1 М уксусной кислоте по формуле, предложенной Фредериком (Е. Fredericq).
5. Содержание в клетках и тканях
Содержание ДНК в органах и тканях животных и человека колеблется в широких пределах и, как правило, тем выше, чем больше клеточных ядер приходится на единицу массы ткани. Особенно много ДНК (около 2,5% сырого веса) в вилочковой железе, состоящей главным образом из лимфоцитов с крупными ядрами. Довольно много ДНК в селезенке (0,7—0,9%), мало (0,05—0,08%) в мозге и мышцах, где ядерное вещество составляет значительно меньшую долю. На ранних стадиях эмбрионального развития в этих органах содержится больше ДНК, но содержание ее уменьшается в процессе онтогенеза по мере дифференцировки. Однако количество ДНК на одно клеточное ядро, содержащее диплоидный набор хромосом, практически постоянно для каждого биологического вида. Соответственно количество ДНК в ядрах половых клеток вдвое ниже. По этой же причине различные физиологические и патологические факторы почти не влияют на содержание ДНК в тканях, а при голодании, например, относительное содержание ДНК даже возрастает за счет снижения концентрации других веществ (белков, углеводов, липидов, РНК). У всех млекопитающих количество ДНК в диплоидном ядре почти одинаково и составляет около 6 1012 г, у птиц — около 2,5 10-12, у разных видов рыб, амфибий и простейших оно колеблется в значительных пределах.
Содержание ДНК в бактериях довольно велико и достигает нескольких процентов в пересчете на сухой вес; в вирусах оно может доходить до 50%. Вместе с тем абсолютное количество ДНК в бактериальной клетке в среднем на два порядка ниже, чем в клеточном ядре высших организмов, а в ДНК-содержащих вирусах оно ниже еще на два порядка.
У бактерий одна гигантская молекула ДНК образует генофор, соответствующий хромосоме высших организмов. Так, у кишечной палочки Escherichia coli молекулярный вес такой кольцеобразной двуспиральной молекулы достигает около 2,5-Ю9 и длины, превышающей 1,2 мм. Эта огромная молекула плотно упакована в небольшой «ядерной области» бактерии и соединена с бактериальной мембраной.
В хромосомах высших организмов (эукариотов) ДНК находится в комплексе с белками, главным образом гистонами; в каждой хромосоме содержится, по-видимому, одна молекула ДНК длиной до нескольких сантиметров и молекулярным весом до нескольких десятков миллиардов. Такие огромные молекулы умещаются в клеточном ядре и в митотических хромосомах длиной в несколько микрометров. Часть ДНК остается не связанной с белками; участки несвязанной ДНК перемежаются с блоками ДНК, связанной с гистонами. Показано, что в таких блоках содержится по две молекулы гистонов 4 типов: Нда, Hab, Hg и Н4.
Помимо клеточного ядра, ДНК содержится в митохондриях и в хлоропластах. Количество такой ДНК обычно невелико и составляет небольшую долю общей ДНК клетки. Однако в ооцитах и на ранних стадиях эмбрионального развития животных подавляющая часть ДНК локализована в цитоплазме, главным образом в митохондриях. В каждой митохондрии содержится по поскольку молекул ДНК. У животных мол. вес митохондриальной ДНК составляет около 10-106; ее двуспиральные молекулы замкнуты в кольцо и находятся в двух основных формах: сверхскрученной и открытой кольцевой. В митохондриях и в хлоропластах ДНК не находится в комплексе с белками, она ассоциирована с мембранами и напоминает бактериальную ДНК Небольшие количества ДНК обнаружены также в мембранах и некоторых других структурах клеток, однако их особенности и биологического роль остаются неясными.
В процессе биологического синтеза ДНК на матрице аналогичной молекулы ДНК образуется такая же молекула, и количество ДНК удваивается. Поэтому процесс биосинтеза ДНК получил название редупликации или репликации.
Принцип комплементарности (дополнительности), по Уотсону и Крику, заложен в самом строении: ДНК.
Дж. Уотсоном и Ф. Криком было постулировано, что репликация ДНК должна происходить полуконсервативным способом, то есть путем раскручивания двойной спирали и синтеза новых, комплементарных исходной полинуклеотидных цепочек на каждой нити. Именно этот механизм и был доказан экспериментально путем введения в ДНК-матрицу тяжелого азота (радиоактивной метки) и анализа ДНК последующих поколений при помощи центрифугирования в градиенте плотности хлористого цезия или методом авторадиографии.
ДНК синтезируется из дезоксинуклеозидтрифосфатов, которые соединяются в полинуклеотидную цепь с отщеплением пирофосфата. Эта реакция протекает на матрице одноцепочечной предобразованной ДНК под действием фермента ДНК-полимеразы, причем синтезирующаяся: дезоксирибополинуклеотидная цепь дочерней ДНК строго комплементарна матричной цепи. ДНК-полимераза, впервые выделенная из Е. coli, хорошо изучена. Ее молекулярный вес составляет 110 000 дальтонов, под действием трипсина она распадается на 2 фрагмента — активный и неактивный. Для протекания реакции, катализируемой ДНК-полимеразой, необходимы матричная ДНК, обязательное присутствие всех четырех дезоксинуклеозидтрифосфатов и ионов Mg2+. Равновесие реакции сильно смещено в сторону синтеза, оптимальная величина рН 7,5; реакция ингибируется пирофосфатом: концентрация пирофосфата 2•10-3 М угнетает реакцию синтеза на 50%. Показано, что двуспиральная молекула ДНК неактивна в качестве матрицы, однако для инициации репликации на активной матрице одноцепочечной ДНК необходим участок комплементарной ей полинуклеотидной цепи со свободным 3'-ОН-кон-цом рибозы, служащий затравкой для роста вновь синтезирующейся цепи. Эта затравка состоит из рибонуклеотидных остатков, которые удаляются по завершении синтеза комплементарной цепи ДНК. К 3'-ОН-концу затравки ДНК-полимераза последовательно присоединяет дезокспрпбонуклеотидные остатки, соединяющиеся водородными связями с комплементарными основаниями матричной цепи. Рост синтезирующейся цепи происходит в направлении 3'-ОН — 3'-ОН-концам, антипараллельно матричной цепи. Репликация ДНК приводит к удвоению количества генетического материала клетки и, как правило,— к клеточному делению. Поэтому репликация происходит тем чаще, чем короче время генерации вируса или бактерии и чем чаще делятся клетки у высших организмов. Темп репликации высок у эмбрионов, в особенности во время дробления, и замедляется по мере развития и дифференцировки. Вообще темп репликации соответствует митотической активности ткани и поэтому низок в не делящихся клетках, например в клетках мозга пли мышц, и относительно высок в часто делящихся клетках костного мозга или опухолей. Репликация ДНК имеет место и при эндомптозах, приводящих к полиидоидизации ядер. Репликация происходит не во время собственно митоза, а в интеркинетической фазе во время синтетического S-периода клеточного цикла между периодами gi и Ga.
У бактерий и вирусов репликация начинается в одной точке молекулы ДНК. В каждой хромосоме высших организмов таких точек обычно бывает по нескольку сот. В точке начала синтеза ДНК могут образоваться одна пли две репликационные вилки. В первом случае репликация протекает в одном направлении; обычно же образуются две вилки, которые движутся по молекуле ДНК в противоположных направлениях. 'Такая двунаправленная репликация показана авторадиографическим методом на кольцевых ДНК бактерий, а также у высших организмов. По мере продвижения репликационных вилок образуются дочерние двуспиральные молекулы ДНК, состоящие наполовину из старых цепей и наполовину из комплементарных им новых цепей ДНК.
Исследование Окадзаки (R. Oka-zaki) биосинтеза ДНК у бактерий показало, что сначала синтезируются сравнительно короткие фрагменты дезоксирибополинуклеотидных цепей длиной до 1000 нуклеотидных остатков, которые затем сшиваются между собой ферментом ДНК-лигазой (полинуклеотидлигазой). Одна из двух цепей ДНК при этом растет непрерывно, а другая прерывисто. Образование фрагментов Окадзаки показано и у высших организмов. Показано, что разъединение и раскручивание двух полинуклеотидных цепей двойной спирали ДНК, необходимое для репликации, осуществляется при помощи особого ДНК-связывающего белка.
Репликация вирусных и нескольких кольцевых молекул ДНК имеет некоторые особенности. Так, одноцепочечная ДНК вируса Ф Х174 сначала синтезирует на своей матрице комплементарную цепь — так называемый минус-цепь. Эта цепь замыкается в кольцо ДНК-лигазой и образует биологически активную репликативную форму ДНК бактериофага. А. Корнбергом эта последовательность реакций была воспроизведена вне организма, и таким образом впервые была получена синтетическая биологически активная репликативная форма ДНК. У кольцевых молекул ДНК митохондрий обнаружено присутствие небольшого фрагмента длиной около 450 нуклеотидных остатков, комплементарного одной («легкой») цепи двуспиральной молекулы ДНК. Другая («тяжелая») цепь в этом участке смещается и образует так называемую D-петлю. Названный фрагмент служит начальным участком синтезирующейся «тяжелой» цепи ДНК, «легкая» цепь синтезируется на освободившейся «тяжелой» цепи исходной ДНК. Репликация происходит асимметрически в одном направлении и начинается с предобразованных фрагментов. В ДНК паповавирусов, например вируса SV 40 и вируса папилломы, репликация идет сразу в двух направлениях. У бактерий репликация, по всей вероятности, начинается в месте прикрепления ДНК к мембране. У высших организмов ДНК хромосом также связана с внутренней мембраной ядра, однако значение этой связи в процессе репликации пока не ясно.
Помимо репликации ДНК, в организме происходит репарация ДНК, то есть восстановление поврежденных, разрушенных или измененных участков полинуклеотидных цепей. Разрывы в одной из полинуклеотидных цепей ДНК, по-видимому, репарируются под действием ДНК-лигазы. Более сложные повреждения, например образование димеров тимина под действием ультрафиолетовой радиации, ликвидируются следующим образом: поврежденный участок, содержащий димер тимина, «вырезается» при помощи эндонуклеазы (обычно это олигонуклеотид, три-илп тетрануклсотид), а брешь заполняется нормальным нуклеотидным блоком. В процессе репарации участвует ряд ферментов: эндо-, экзо-1 и экзо-11 нуклсазы и ДНК-полимераза. Расшифровка механизмов повреждения и репарации ДНК несомненно приведет к более эффективной профилактике и терапии болезней, вызванных радиационными и химическими мутагенами.
При изучении мутанта Е. coli, чувствительного к ультрафиолетовому облучению, выяснилось, что он дефектен и в отношении ДНК-полимеразы. Однако у этого мутанта (Ро1А~) продолжалась репликация ДНК. На этом основании возникло предположение, что описанная А. Корнбергом полимераза участвует в репарации и не участвует в репликации. Вскоре из мутанта Ро1А" была выделена другая ДНК-полимераза, сходная по механизму действия с ранее известной, но отличная от нее по некоторым свойствам. ДНК-полимеразу II стали считать ответственной за репликацию. Затем была выделена ДНК-полимераза III, по своим свойствам напоминающая ДН1-?-полимеразу I. Таким образом, обнаружено три ДНК-полпмеразы, причем, по-видимому, для репликации необходима именно ДНК-полимераза III.
В онкогенных РНК-содержащих вирусах (онкорнавирусах) обнаружен фермент, катализирующий синтез комплементарной цепи ДНК на матрице, то есть процесс, обратный процессу переноса информации от ДНК к РНК. Этот фермент получил название «РНК-зависимая ДНК-полимераза» или «обратная транскриптаза». Открытие этого фермента означало успех науки о злокачественных опухолях — онкологии. Ранее было установлено, что при злокачественном перерождении клеток под действием онкогенных вирусов происходит включение ДНК вируса в хромосому клетки хозяина. Однако из этой закономерности выпадали РНК-содержащие онкогенные вирусы. Оказалось, что они содержат обратную транскриптазу, которая сразу после заражения по вирусной РНК синтезировала вирусную ДНК, которая и внедрялась в хромосому клетки хозяина.
В ряде случаев, например в ооцитах для рибосомной ДНК, имеет место амплификация (умножение) определенных участков ДНК. Механизм амплификации не совсем ясен; по-видимому, происходит репликация отдельных участков ДНК, содержащих цистроны тех РНК, которые усиленно синтезируются в данных условиях.
Катаболизм ДНК не представляет каких-либо особенностей. В кишечном тракте и в тканях ДНК гидролизуются под действием дезоксирибонуклеаз; образовавшиеся нуклеотиды гидролизуются нуклеотидазами, а образующиеся пуриновые и пиримидиновые основания и сахара расщепляются обычными путями.
Цитогенетические исследования в 20—30-х гг. 20 в. свидетельствовали о том, что передача и хранение наследственных признаков связаны с хромосомами, находящимися в ядерном веществе. То, что наследственным веществом является именно ДНК, а не белок, стало ясным в результате исследований, проведенных в 40-х гг. 20 в. на бактериях и бактериофагах (см. Ген).
В 1944 г. Эйвери, Мак-Лауд и Мак-Карти (О. Т. Avery, С. М. Мас-Leod, М. McCarty) установили природу трансформирующего фактора у бактерий. Им оказалась ДНК. Процесс трансформации состоит, несомненно, из ряда стадий: обратимой сорбции молекул ДНК бактериальной клеткой; внедрения этих молекул внутрь клетки; интеграции молекулы чужой ДНК в хромосому клетки, расщепления образовавшейся сложной структуры и ее перехода в рекомбинанты.
При исследовании бактериальных вирусов под электронным микроскопом пли при помощи радиоактивной метки, вводимой в белок или в ДНК бактериофага, было показано, что вирус, фиксируясь на поверхности бактериальной клетки, вводит в нее только молекулу ДНК, оставляя снаружи свою белковую оболочку. Молекула ДНК вируса, попавшая в клетку, несущая в себе всю наследственную информацию (геном) вируса, вызывает образование в клетке новых вирусных частиц, их размножение и гибель клетки от лизиса.
Некоторые, так называемые умеренные, фаги у части бактериальных клеток не вызывают явных признаков заражения, однако их ДНК, попадая в клетку, прочно связывается с геномом самой бактерии, интегрируясь с ДНК бактериальной клетки. Многие поколения таких бактерий несут в себе бактериофаг в скрытом виде, не проявляя признаков нарушения жизнедеятельности. Однако при неблагоприятных условиях и при действии каких-либо повреждающих факторов, например ионизирующей или ультрафиолетовой радиации, вирус в таких бактериях начинает размножаться и вызывает лизис (гибель) бактерий. ДНК вируса настолько прочно связывается с ДНК бактерий, что заражение вирусом, полученным от лизогенных бактерий, сопровождается переносом вместе с ДНК вируса части ДНК бактерий, с которой передаются некоторые наследственные свойства этих бактерий, отсутствующие и у вновь заражаемых бактерий, и у самого вируса. Это явление, сходное с трансформацией, получило название трансдукции .
Последовательность нуклоотидов в цепи ДНК переписывается в комплементарную ей последовательность нуклеотидов в молекуле РНК — так называемая транскрипция. Процесс этот осуществляется при участии фермента РНК-полимеразы. Генетическая информация, переписанная с ДНК на РНК, в конечном счете определяет первичную структуру (последовательность аминокислотных остатков в строящейся молекуле белка). При помощи электронной микроскопии удалось увидеть рост цепей РНК на матрице ДНК, то есть работу гена на уровне транскрипции.
В процессе реализации или выражения генов имеет место кодирование генетической информации. Показано, что три последовательно расположенных нуклеотидных остатка (триплет) в цепи ДНК кодируют комплементарный триплет в цепи РНК, который в свою очередь контролирует включение одной, строго определенной аминокислоты в полипептидную цепь синтезирующегося белка. Установлено, что полипептидная цепь синтезируется колинеарно с ДНК, то есть в соответствии с линейным расположением триплетов ДНК. Известно, какие именно триплеты кодируют включение каждой аминокислоты.
Последовательность нуклеотидов ДНК, кодирующая образование определенной полипептидной цепи, представляет собой структурный ген, или цистрон. Изменение даже одной пары нуклеотидов в цистроне (точковая мутация) может привести к изменению структуры белка и потере им биологического активности. Такие точковые мутации могут представлять собой транзиции (замену пары нуклеотндов ГЦ на AT или наоборот), трансверсии (замена AT на ТА или ГЦ на Ц Г, то есть перемещение комплементарных оснований из одной цепи в другую), вставки пары нуклеотидов или их делецию (выпадение). Трансверсии и транзиции приводят обычно к замене одной аминокислоты в строящейся полипептидной цепи, тогда как вставки и делении вызывают изменение порядка считывания и приводят к глубокому нарушению структуры белка. Вставка же или делеция сразу трех пар нуклеотидов, то есть целого триплета, восстанавливает последовательность считывания, что и послужило одним из важнейших доказательств триплетности кода.
У высших организмов количество ДНК на геном достаточно для кодирования миллионов белков. В действительности число генов у человека и высших животных по крайней мере на порядок ниже и находится, по-видимому, между 10 000 и 100 000. Огромное количество избыточной ДНК, таким образом, не несет структурных генов и выполняет иные функции. Оказалось, что часть ДНК вообще не участвует в процессе транскрипции, а преобладающая часть РНК, синтезированной на матрице ДНК у высших организмов, претерпевает распад внутри клеточного ядра, не участвуя в синтезе клеточных белков. В связи с этим Г.П. Георгиевым была высказана гипотеза, согласно которой оперон (последовательность генов, контролирующих синтез ферментов, участвующих в катализе всех этапов одного и того же процесса) у высших организмов содержит большое число регуляторных генов, расположенных в начале считывания. Синтезирующаяся на таком опероне гигантская молекула РНК распадается в процессе ее переноса в цитоплазму, куда поступает только собственно информационная РНК, содержащая структурные гены и кодирующая синтез клеточных белков. Остальная часть этой РНК имеет регуляторные функции и распадается внутри ядра.
Особенностью высших организмов является также дифференцировка клеток и тканей. Гены, содержащиеся в ДНК каждой диплоидной клетки одного и того же организма (геном), качественно и количественно совершенно одинаковы, однако тот факт, что разные ткани и клетки резко различны по своему составу, строению и функциям, объясняется тем, что в них синтезируются неодинаковые белки. Таким образом, помимо регуляции активности действующих генов, при дифференцировке имеет место выключение или блокирование большей части генов, причем обычно активной остается небольшая часть генома, а в некоторых случаях синтезируется лишь один или несколько белков, например синтез гемоглобина в ретикулоцитах. Механизмы диффе-ронцпровкп во многом не ясны, однако показано, что белки, входящие в состав дезокснрибонуклеопро-теидов хроматина, оказывают выраженное действие на транскрипцию. Гистоны подавляют этот процесс, а кислые белки могут активировать его. Неактивные участки хроматина цитологически представляются более плотными, а в процессе транскрипции, напротив, хроматин выглядит более рыхлым и нити ДНК, по-видимому, частично отделяются от гистонов. Различными методами показано, что транскрипция ДНК происходит в разрыхленных участках хроматина, в так называемых пуфах, представляющих собой вздутие хромосом в области действующих генов.
8. Гистохимические методы обнаружения в тканях
В основе гистохимических методов выявления нуклоиновых кислот лежат реакции на все компоненты, входящие в их состав. В растущих тканях происходит быстрое обновление пуринов, пиримидинов, фосфорных соединений и Сахаров. Этим пользуются для избирательного выявления в них ДНК авторадпографическим методом с помощью 3Н-тимпдпна. ДНК образует соли с щелочноземельными и тяжелыми металлами. Остатки фосфорной кислоты, которые обычно связаны с ядерными белками (чаще всего гистонами), при вытеснении последних легко вступают в химические реакции с основными красителями. Для этого могут быть использованы сафранин О, янус зеленый В, толуидиновый синий, тионин, азур А и не которые другие красители, разведенные растворы которых в уксусной кислоте избирательно окрашивают хроматин. Для количественного гистохимические определения ДНК рекомендуется метод с применением галлоцианин-хромосовых квасцов, который обладает двумя ценными качествами. Галлоцианинхромовые квасцы дают устойчивую окраску, которая не меняется при обезвоживании и просветлении срезов в ксилоле. Окрашивание можно проводить при любом значении рН от 0,8 до 4,3, однако рекомендуется работать при оптимальном значении рН для этого красителя — 1,64, так как при нем происходит максимальное специфическое выявление ДНК. При окрашивании галлопианинхромовыми квасцами ДНК соединяется с красителем в стехиометрическом соотношении, причем отношение краситель: ДНК составляет 1:3,7.
Наиболее распространенной реакцией на ДНК считается реакция Фейльгена. Она проводится после мягкого гидролиза предварительно фиксированной ткани в 1 и. НС1 при 60°, в результате чего от дезоксирибозофосфата отщепляются пурины, а затем и ппрпмпдины, освобождая тем самым реакционноспособные альдегидные группы, которые реактивом Шиффа окрашиваются в красный цвет. Время гидролиза зависит от природы объекта и метода фиксации. Для получения хороших результатов необходимо в каждом отдельном случае время гидролиза подбирать экспериментально.
Для проверки специфичности реакции Фейльгена существует метод ферментативного и кислотного экстрагирования ДНК. Ферментативное расщепление ДНК проводят дезоксирибонукдеазой при концентрации ферментного препарата 2 мг на 100 мл 0,01 М трисбуфера рН 7,6; раствор перед употреблением разводят диетической водой в соотношении 1:5. Рекомендуется инкубировать срезы при 37° в течение 2 час. Другим способом удаления ДНК служит обработка гистохимических препаратов 5% водным раствором трихлоруксуснои кислоты в течение 15 мин. при 90° или 10% горячей (70°) хлорной кислотой в течение 20 мин., после чего реакция Фейльгена должна дать отрицательные результаты.
Молекула ДНК – очень длинная двойная цепочка, спирально закрученная вокруг своей продольной оси. Длина ее во многие сотни раз превышает длину цепочки белковой молекулы. Каждая одинарная цепочка представляет собой полимер и состоит из отдельных соединенных между собой мономеров – нуклеотидов. В состав любого нуклеотида входят два постоянных химических компонентов (фосфорная кислота и углевод дезоксирибоза) и один переменный, который может быть представлен одним из четырех азотистых оснований: аденином, гуанином, тимином или цитозином. Поэтому в молекулах ДНК всего четыре разных нуклеотида. Разнообразие же молекул ДНК огромно и достигается благодаря различной последовательности нуклеотидов в цепочке ДНК.
Две цепи ДНК соединены в одну молекулу азотистыми основаниями. При этом аденин соединяется только с тимином, а гуанин – с цитозином. В связи с этим последовательность нуклеотидов в одной цепочке жестко определяет последовательность их и в другой цепочке. Строгое соответствие нуклеотидов друг другу в парных цепочках молекулы ДНК получило название комплементарности. Это свойство лежит в основе образования новых молекул ДНК на базе исходной молекулы.
Редупликация сводится к тому, что под действием специального фермента исходная двойная цепочка молекулы ДНК постепенно распадается на две одинаковые – и тут же к каждой из них по принципу химического сродства (аденин к тимину, гуанин к цитозину) присоединяются свободные нуклеотиды. Так восстанавливается двойная спираль ДНК. Но теперь таких двойных молекул еще две. Поэтому синтез ДНК и получил название редупликации (удвоения): каждая молекула ДНК как бы сама себя удваивает. Роль ДНК заключается в хранении, воспроизведении и передаче из поколения в поколение наследственной информации.
1. Ашмарин И.П. Молекулярная биология, М., 2004;
2. Бреслер С.Е. Молекулярная биология, СП-Б., 2003,
3. Георгиев Г.П. О структуре единиц транскрипции в клетках эукариотов, Усл. биологического химии, под ред. Б. Н. Степаненко, т. 14, с. 3, М., 2003,
4. Дэвилсон Дж. Биохимия нуклеиновых кислот, пер. с англ., М., 2006:
5. Клеточное ядро, Морфотогия, физиология, биохимия, под ред. И. Б. Збарского и Г. П. Георгиева, М., 2002;
6. Лилли Р. Д. Патологическая техника и практическая гистохимия, пер. с англ., М., 1969,
7. Методы исследования нуклеиновых кислот, пер. с англ., под ред. А. Н. Белозерского, М., 2000;
8. Пирс Э. Гисточимия, пер. с англ., М., 1962:
9. Строение ДНК и положение организмов в системе, под ред. А. Н. Белозерского и А. С. Антонова, М., 2002;
10. Уотсон Дж. Молекулярная биология гена, пер. с англ., М., 1967;
11. Химия и биохимия нуклеиновых кислот, под ред. И. Б. Збарского и С.С. Дебова, Л., 1968;